实验室配制1mol·L-1盐酸250mL,下列不需用的仪器是
| A.250 mL容量瓶 | B.托盘天平 | C.胶头滴管 | D.烧杯 |
在100 mL某一元弱酸的溶 液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。
液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。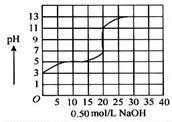
下列叙述正确的是( )
A.该弱酸在滴定前 的浓度是0.15 mol/L 的浓度是0.15 mol/L |
| B.该弱酸稀释10倍后pH为4 |
| C.滴定过程为求滴定终点,最合适的指示剂是酚酞 |
| D.滴定过程为求滴定终点,最合适的指示剂是甲基橙 |
对平衡CO2(g) CO2(aq);△H =-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()
CO2(aq);△H =-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()
| A.升温增压 | B.降温减压 | C.升温减压 | D.降温增压 |
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。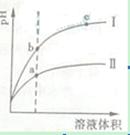
据图判断正确的是( )
| A.Ⅱ为盐酸稀释时pH值变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点Kw的数值比c点Kw的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |
温室时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( ).
| A.若pH>7时,则一定是c1v1=c2v2 |
| B.在任何情况下都是c(Na+) + c(H+)=c(CH3COO-) + c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2, c1=c2,则c(CH3COO-) + c(CH3COOH)=c (Na+) |
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液洗涤油污的能力强 ②误将钡盐〔BaCl2、Ba(NO3)2〕当作食盐混用后,常用0.5%的Na2SO4溶液解毒 ③溶洞、珊瑚的形成④碳酸钡不能做“钡餐”而硫酸钡则能 ⑤泡沫灭火器灭火的原理
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |