在某温度下,在一容积可变的容器中,反应2A(g)+B(g) 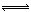 2C(g)达平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B. 均加倍 C. 均增加1mol D. 均减少1mol
(NH4)2SO4在强热下分解生成NH3、SO2、N2和H2O,反应中生成的氧化产物和还原产物的物质的量之比是
| A.1: 3 | B.2 : 3 |
| C.1 : 1 | D.4 : 3 |
已知: C(s)+1/2 O2(g_)=CO(g);△H1=" -110.35" kJ/mol
CO(g)+1/2 O2(g)=CO2(g);△H2=" -282.57" kJ/mol
则:C(s)+O2(g)=CO2(g);△H3=
| A.+172.22 kJ/mol | B.-172.22 kJ/mol |
| C.+392.92 kJ/mol | D.-392.92 kJ/mol |
已知土壤胶体带负电,在土壤里施用含氮量相等的下列肥料,肥效较差的是
| A.(NH4)2SO4 | B.NH4HCO3 |
| C.NH4NO3 | D.NH4C1 |
短周期元素X、Y、Z在周期表中的位置关系如图所示,其中正确的是
| X |
||||||
| Y |
||||||
| Z |
|
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+ ; MnO4-→Mn2+ ; IO3-→I2;HNO2→NO。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
| A.Fe3+ | B.MnO4- | C.IO3- | D.HNO2 |