在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下: (已知N2(g)+3H2(g) 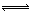 2NH3(g) ΔH=-92.4 kJ·mol-1):
2NH3(g) ΔH=-92.4 kJ·mol-1):
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1 mol N2、3 mol H2 |
2 mol NH3 |
4 mol NH3 |
| NH3的浓度 |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3>1
煤是我国的一种主要能源,在使用煤资源时,下列所采取的措施不合理的是()
| A.燃煤时应将块煤粉碎或磨成粉末 |
| B.燃煤时应通入足量的空气,且越多越好 |
| C.将煤制成水煤气 |
| D.将煤经过处理制成甲醇等 |
某同学按右图所示的装置进行电解实验。下列说法正确的是()

| A. | 电解过程中,铜电极上有 产生 |
| B. | 电解一定时间后,石墨电极不可能有铜析出 |
| C. | 电解初期,主反应方程式为: |
| D. | 整个电解过程中, 的浓度不断增大 |
下列有关金属腐蚀与防护的说法正确的是()
①纯银器表面在空气中因化学腐蚀渐渐变暗②当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用③在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法④可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
以惰性电极电解 溶液,若阳极上产生气体的物质的量为0.01 ,则阴极上析出的铜的质量为()
| A. | 0.64 | B. | 1.28g | C. | 2.56g | D. | 5.12g |
用石墨作电极电解 溶液,通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的()
| A. | B. | C. | D. |