请写出下列溶液水解(或双水解)的离子反应方程式:
(1)次氯酸钠溶液:
(2)硫酸铵溶液:
(3)明矾净水原理:
(4)泡沫灭火器工作原理:
(5) 氯化铁溶液与偏铝酸钾溶液混合:
(10分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:
Y+X→A(g),Y+Z→B(g)请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是。
(2)若常温下Y为淡黄色固体,X、Z为气体,B可把A氧化为Y,则:
①B的化学式是;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
(12分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电于数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若于种化合物。请回答:
(l)B元素的名称是。在周期表中的位置是。
(2)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)。
以下三种说法中,可以验证该结论的是(填写编号) 。
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
(4)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为。
(10分)(1)如图所示,将CL2依次通过盛有干燥有色布条的广□瓶和盛有潮湿有色布条的广口瓶,可观察到灼现象是。
(2)为防止 Cl2,尾气污染空气,可用氢氧化钠溶液吸收多余的Cl2,原理是 (用化学方程式表示 )
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是(填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是(填字母代号)。
A.O2 B.Cl2 C.CO2 D.HCIO
(3)2004年4月15日至16日,位于重厌市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
A.NaOH B.NaCIC.KBr D.Na2CO3
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下:
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
(填字母)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(CO)=c(CH3OH) d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式:。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为。
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛g(精确到0.1,下同),甲醇厂CO的转化率为。
A~H有如图所示的转化关系,其中A是盐,B、C、D、E、F在常温常压下均是气态物质,反应④、⑤均在溶液中进行,转化中反应条件略去。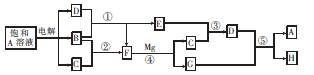
试回答下列问题:
(1)物质A的化学式为,电解时阴极反应式为.
(2)反应③的化学方程式为。
(3)反应⑤的离子方程式为。
(4)镁与铝能形成多种合金,为了确定某合金样品的成分,小明同学设计如图所示的实验步骤,确定合金组成。
①能确定合金组成的数据组有(填字母)。
a.m、n b.m、y c.n、y
②若合金中Mg的物质的量分数为x,金属总物质的量为7 mol,试在图中作出y随x变化的曲线。