下列有关说法正确的是
| A.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗盐酸的体积更大 |
| B.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
| C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 |
| D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
下列叙述正确的是
| A.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| B.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| C.强电解质一定为离子化合物,共价化合物一定为弱电解质 |
| D.通常状态下,若测得纯水的pH小于7,其测定温度一定高于25℃ |
下列反应离子方程式正确的是
| A.Fe2O3固体与氢碘酸溶液反应: Fe2O3+6H+===2Fe3++3H2O |
B.过量澄清石灰水与碳酸氢钙反应: Ca2++HCO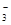 +OH-===CaCO3↓+H2O +OH-===CaCO3↓+H2O |
C.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===[Al(OH)4]—+4NH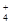 |
D.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO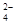 |
===BaSO4↓+H2O
下列说法正确的是
A.若M+和R2-的核外电子层结构相同,则原子序数:R>M
B.由C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键
C.元素Li、C、P的氯化物中,各原子均满足最外层8电子稳定结构
D.盛溴的试剂瓶里加少量水以减少溴的挥发
下列有关实验的叙述中,正确的是
| A.容量瓶在使用前须用待配溶液润洗 |
| B.将二氧化硫通入到紫色石蕊试液中,试液先变红后褪色 |
| C.称量氢氧化钠固体时,应将氢氧化钠固体放在称量纸上称量 |
| D.加热时,可将试管、蒸发皿、坩埚直接在酒精灯上加热 |
下列化学用语或模型表示正确的是
| A.Na2O2的结构式:Na—O—O—Na | B.CCl4分子的球棍模型: |
| C.乙炔的结构简式 CHCH | D.Cl-离子的结构示意图: |