在下列溶液中,能大量共存的一组离子是 ( )
A.某无色透明的酸性溶液:Cl-、Na+、MnO4-、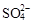 |
| B.中性溶液中:Fe3+,Al3+,NO3-,I-,Cl- |
| C.在强碱溶液中:Na+、K+、CO32-、NO3- |
| D.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
一定温度下反应4A(s)+3B(g)  2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是()
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是()
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是1∶2∶3
C.2 min末的反应速率v(B)=0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是逐渐减小的
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应
速率最快的是()
| A.v(CO)=1.5 mol·L-1·min-1 |
| B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 |
| D.v(CO2)=1.1 mol·L-1·min-1 |
下列有关化学反应速率的说法不正确的是()
| A.化学反应达到最大限度时,正逆反应速率也达到最大且相等 |
| B.催化剂能降低化学反应的活化能,加快反应速率,提高生产效率 |
| C.用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 |
| D.用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
在298 K、1.01×105Pa下,将22 g CO2通入1 mol·L-1NaOH溶液750 mL中充分反应,
测得反应放出x kJ的热量。已知该条件下,1 mol CO2通入2 mol·L-1NaOH溶液1 L中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是()
| A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1 |
| B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=(4x-y)kJ·mol-1 |
| C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1 |
| D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1 |
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1;H2(g)+O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1。CO2气体与H2气体反应生成甲烷气体与液态水的热化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH3,其中ΔH3的数值为()
| A.-252.9 kJ·mol-1 | B.+252.9 kJ·mol-1 |
| C.-604.5 kJ·mol-1 | D.+604.5 kJ·mol-1 |