设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B.电解精炼铜时每转移NA个电子,阳极溶解32g铜 |
| C.标准状况下,18gH2O中含有的原子数目为3NA |
| D.室温下,31.0g白磷中含有的共价键数目为NA |
现有分子式均为C3H6O2的四种有机物A、B、C、D,把它们分别进行下列实验加以鉴别,其实验记录如下:(已知同一碳原子上不能连接两个或两个以上官能团)
| NaOH溶液 |
银氨溶液 |
新制Cu(OH)2 |
金属钠 |
|
| A |
中和反应 |
—— |
溶解 |
产生氢气 |
| B |
—— |
有银镜 |
有红色沉淀 |
产生氢气 |
| C |
水解反应 |
有银镜 |
有红色沉淀 |
—— |
| D |
水解反应 |
—— |
—— |
—— |
(1) 则A、B、C、D的结构简式分别为:
A、B、C、D.
(2) 写出D与NaOH溶液反应的方程:.
某有机物的结构简式如下图所示,则关于它的说法中不正确的是()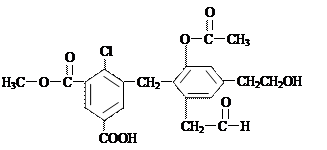
| A.1 mol该有机物消耗NaHCO3、NaOH、Na的物质的量之比为 1∶5∶3 |
| B.1 mol该有机物与足量的银氨溶液反应可得到2mol Ag |
| C.1 mol该有机物可与6 mol H2发生加成反应 |
| D.该有机物可发生消去反应、氧化、水解、中和反应 |
烯烃复分解反应的研究荣获了2005年诺贝尔化学奖,其反应可形象地描述为“交换舞伴”.催化剂金属卡宾(如CH2═M)与烯烃分子相遇后,“两对舞伴”会暂时组合起来,手拉手跳起“四人舞蹈”.随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是新的金属卡宾.后者会继续寻找下一个烯烃分子,再次“交换舞伴”.若把C6H5CH2CH═CH2与CH2═M在一定条件下混合反应,下列产物不可能生成的是()
| A.C6H5CH2CH═M | B.CH2═CH2 |
| C.C6H5CH═CHC6H5 | D.C6H5CH2CH═CHCH2C6H5 |
H是一种性能优异的压电高分子材料,其结构简式为 
已被广泛应用于声、热、光的传感等方面.它是由CH≡CH、(CN)2、CH3COOH、H2O四种单体通过适宜的反应形成的.由H的结构简式分析,合成过程中发生反应的类型可能有()
| A.取代反应 | B.消去反应 | C.加成反应 | D.缩聚反应 |
人类已进入网络时代,长时间看显示屏幕的人,会感到眼睛疲劳,甚至会对眼睛有一定的伤害.人眼中的视色素中含有视黄醛(见甲)作为辅导基的蛋白质,而与视黄醛相似结构的维生素A(见乙)常作为保健药物.已知CH3CH=CHCH3可用“”表示,则下列有关叙述正确的是()
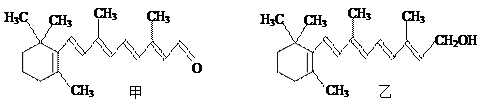 |
| A.维生素A是视黄醛的还原产物 | B.视黄醛和维生素A互为同分异构体 |
| C.视黄醛的分子式为C20H26O | D.1mol视黄醛最多能与5molH2加成 |