聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。
装置A中发生反应的化学方程式为___________________。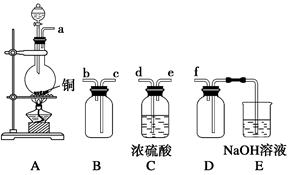
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准 溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol·L-1 NaOH溶液中,充分反应。NaOH溶液的体积V≥______。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”或“偏低”)。
【探究二】实验方案:铝镁合金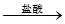 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是:_____(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________。
②______________________________。
【探究三】
实验方案:称量x g铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:
(1)欲计算镁的质量分数,该实验中还需测定的数据是______。
(2)若用空气(不考虑CO2)代替O2进行实验,对测定结果有何影响? _____(填“偏高”、“偏低”或“无影响”)。
某化学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置。实验时将A、D中产生的气体同时通入C中。(K为止水夹,部分夹持仪器已略去)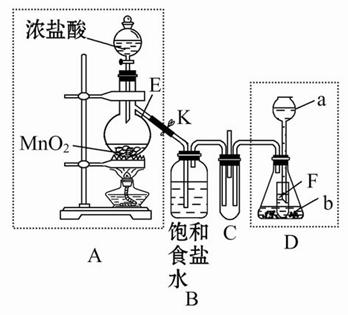
回答下列问题:
(1)简述实验前检查A部分装置气密性的方法_______________________________________。
(2)仪器E的名称是______,锥形瓶内小试管F的作用是______。
(3)若b是生石灰,a是______时,在C中有白烟产生,写出生成白烟的化学方程式________________________。
(4)若a是质量分数为75%的硫酸,b是亚硫酸钠粉末,在C中盛适量的BaCl2溶液时,写出C中发生反应的离子方程式:____________。
(5)从环保的角度出发,上述实验装置中需要改进的是____________________________________________。
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4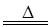 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。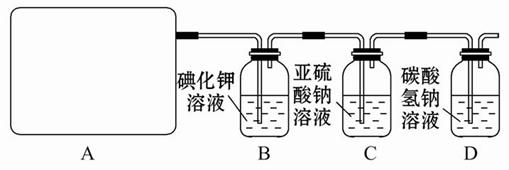
试回答:(1)该实验中A部分的装置是____(填写装置的序号)。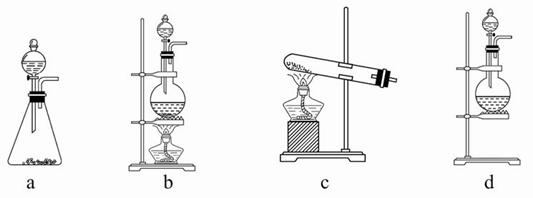
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):____________________________。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式
__________________。
(4)该实验存在明显的缺陷,请你提出改进的方法___________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为: 2Na2S2O3+I2=Na2S4O6 + 2NaI 反应完成时,共用去Na2S2O3
20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为:_____________。
今有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用如图装置进行实验,填写下列空白: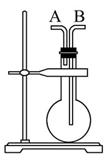
(1)当烧瓶干燥时,从A口进气可收集的气体是_____,从B口进气可收集的气体是____。
(2)当烧瓶中充满水时,可用来测量____等气体的体积。
(3)当烧瓶中装入某种溶液,用于洗气时,气体应从____口进入烧瓶。
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有_________中的一种或两种。
| 实验操作 |
预期现象 |
结论 |
|
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 |
||
| 步骤②:_________ |
含有Fe3+ |
||
| 验证猜想Ⅱ |
将所得气体通入如下装置 |
含有两种气体 |
【实验探究】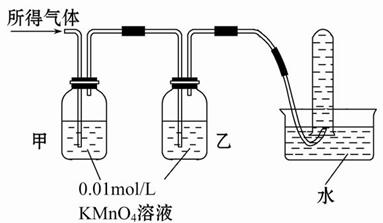
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:_________。