实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。将W g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2,现按如下图所示的装置进行实验: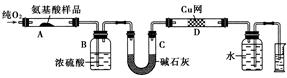
试回答:
(1)实验开始时,首先要通入一段时间的氧气,其理由是
________________________________________________________________________。
(2)以上装置中需要加热的仪器有________,操作时应先点燃
________处的酒精灯。
(3)A装置中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(4)装置D的作用是
________________________________________________________________________。
(5)读取N2体积时,应注意:①____________________________;②__________________________。
(6)实验中测得N2的体积为V mL(已换算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据是( )
| A.生成二氧化碳气体的质量 |
| B.生成水的质量 |
| C.通入氧气的体积 |
| D.氨基酸的相对分子质量 |
下列依据热化学方程式得出的结论正确的是(双选)( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是( )。
A.2SO3(g) 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g) SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
已知:①CH3OH (g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+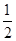 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+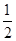 O2(g)===CO2(g)+2H2(g)的 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
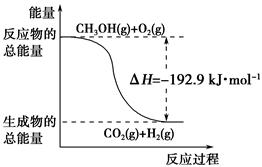
| D.反应②中的能量变化如下图所示 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于 ( )。
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |