某研究性学习小组探究在含有盐酸的Cu2+、Ca2+的混合溶液中滴加Na2CO3溶液时发生反应的过程。(已知 Ksp{Cu(OH)2小于Ksp(CuCO3)}
取适量样品溶液,插入pH传感器并逐滴滴入Na2CO3溶液,测得pH变化曲线如下图所示: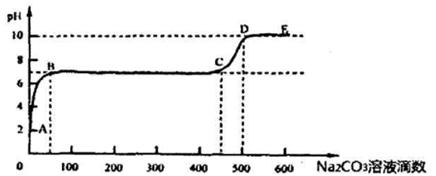
(1)为简单而精确地控制加入的Na2CO3溶液的体积,可将碳酸钠溶液置于 (填仪器名称)中滴加。
(2)图中有二个pH增加较快的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对于a.b之间溶液PH值变化缓慢的本质,该小组同学做出了如下推测,请补充推测2和3:
推测1:生成了Cu(OH)2沉淀,消耗了CO32-;推测2: ;
推测3: ;
若推测1符合实际情况,则此情况下反应的离子方程式为 ;
(4)请设计实验验证检测推测1,不要写出详细的实验过程,试剂不受限制。
| 实验方法、步骤 |
实验现象和结论 |
| |
|
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系。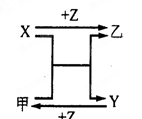
回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为,乙的电子式为。
(2) 若X基态原子外围电子排布式为3s1,Y具有许多优越的性能,被称为未来金属,甲中共含有90个电子,则其分子式为,Y的电子排布式为。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:,Y原子基态电子排布式为。
用VSEPR模型和杂化轨道理论相关知识填表:
| 分子或离子 |
孤对电子对数 |
VSEPR模型名称 |
中心原子杂化轨道类型 |
分子或离子的立体构型名称 |
| CH4 |
0 |
正四面体形 |
sp3 |
正四面体形 |
| BeCl2 |
||||
| SO2 |
||||
| CH3+ |
||||
| SO42- |
||||
| NCl3 |
(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=__________。
(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=__________。
(3)某温度(t℃)时,水的KW=10-13,则该温度______25℃(填大于、等于或小于),理由是_________________________________________________;将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,①若所得混合溶液为中性,则a :b =_________;
②若所得混合溶液pH=2,则a :b =__________。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。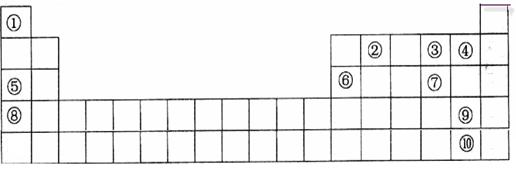
用化学符号回答下列问题:
(1)表中最活泼的金属与最活泼的非金属形成的物质是;
(2)⑤、⑥、⑧的最高价水化物的碱性由强到弱的顺序是;
③、④、⑦氢化物稳定性由强到弱的顺序是;
(3)③与⑤按原子个数1:1所成的化合物的电子式为________________;该化合物与水反应的离子方程式为________________。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物反应的离子方程式为;
(5)请设计一个实验方案,比较⑨、⑩的单质氧化性的强弱:。
下列五种物质中① Ar② H2O2③ NH4 NO3④ KOH⑤ Na2O2⑥ CaCl2只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。(填写序号)