有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O 三种元素的质量比为6:1:4,且A不能使Br2的CCl4溶液褪色;1mol B反应生成了2mol C。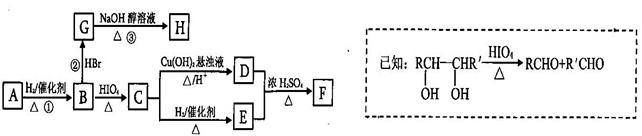
请回答下列问题:
(1)C→E的反应类型为_______________________ 。
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.09%,则由A合成H的总产率为___________________ 。
(3)A的结构简式为__________________________ 。
(4)写出C与银氨溶液反应的离子方程式为________________________________ 。
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为: ___________________。
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________________________。
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)
(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式:、。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式:;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过 程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科
程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科 (Ⅰ)4AgNO32Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO32Ag2O+4NO2↑+O2↑, (Ⅱ)2AgNO32Ag+2NO2↑+O2↑。
(Ⅱ)2AgNO32Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是,并说明理由:。
请你设计一个简单的实验证明你的结论是正确的:。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律:。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究.填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因I:Cl-对反应具有促进作用,而 对反应没有影响;
对反应没有影响;
原因II:_ __________________________________;
__________________________________;
原因III:Cl-对反应具有促进作用,而 对反应具有阻碍作用;
对反应具有阻碍作用;
原因IV:Cl-、 均对反应具有促进作用,但Cl-影响更大;
均对反应具有促进作用,但Cl-影响更大;
原因V:____________________________________________________
(2)该同学设计并进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和稀盐酸的试管(两试管的 规格相同)中:
规格相同)中:
①在盛有稀硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
②在盛有稀盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。若观察到实验1中_________,实验2中__________,则说明原因III是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(3)为了使实验“定量化”, 使结果更精确,可以对实验进行如下改进:
使结果更精确,可以对实验进行如下改进:
①配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用________(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为____________。
配制溶液时还需要用到的玻璃仪器有_____________、__________、烧杯、胶头滴管和量筒等。
②比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。
常温下有一PH为12的NaOH溶液100mL,如果将其PH将为11,那么
(1)若用蒸馏水应加入mL(2)若用PH=10的NaOH溶液应加入mL
(3)若用PH=2的盐酸应加入mL(4)若用0.01mol/L的硫酸溶液应加入mL
常温下已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
(1)高碘酸是(填“强酸”或“弱酸”),理由是。
(2)0.01mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合所得溶液中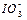 与Na+的浓度关系是(填“大于”“小于”或“等于”)。
与Na+的浓度关系是(填“大于”“小于”或“等于”)。
(3)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的还原剂是,该反应的离子方程式可表示为。
(14分)(1)Na2SO3溶液蒸干得到的固体物质是___________,原因是______________.
(2)碳酸氢钡溶液蒸干得到的固体物质是___________,原因是___________________.
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为_________,原因是_____________________________________________________。
(4)与c(H+)·c(OH-)=kw类似,FeS饱和溶液中存在:FeS(s) 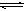 Fe
Fe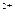
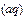 +S
+S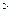
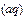 ,
,
c(Fe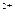 )·c(s
)·c(s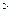 )=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
)=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
理论上FeS的溶解度为___________________。