研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0. 112L气体后便停止加热了,冷却后放人足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
| A.0. 448L | B.2.016L | C.2.240L | D.无法确定 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)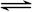 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。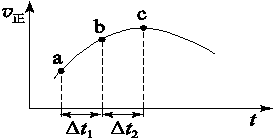
图6
由图可得出的正确结论是( )
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
| A.正极反应式:Ag+Cl--e-=AgCl | B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C. Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
电解法提取氯化铜废液中的铜,方案正确的是()
| A.用铜片连接电源的正极,另一电极用铂片 |
| B.用碳棒连接电源的正极,另一电极用铜片 |
| C.用氢氧化钠溶液吸收阴极产物 |
| D.用带火星的木条检验阳极产物 |
纽扣电 池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为: Z n +2OH-→Zn(OH)2+2e-Ag2O+ H2O+ 2e-→2Ag +2OH-下列说法正确的是:()
池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为: Z n +2OH-→Zn(OH)2+2e-Ag2O+ H2O+ 2e-→2Ag +2OH-下列说法正确的是:()
A、溶液中OH-向正极移动,K+、H+向负极移动
B、锌发生还原方应,氧化银发生还原反应
C、锌是负极,氧化银是正极
D 、在电池放电过程中,电解质溶液的酸碱性基本保持不变
、在电池放电过程中,电解质溶液的酸碱性基本保持不变
下列反应的热化学方程式为:(1)C(s)+O2(g)=CO2(g) ;ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ;ΔH 2=-870.3kJ/mol
(3)H2(g)+ O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的ΔH为()
| A.488.3 kJ/mol | B.-488.3 kJ/mol | C.-244.15 kJ/mol | D.244.15 kJ/mol |