已知:在101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol。下列有关热化学方程式的叙述正确的是 ( )
| A.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
| D.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2 |
根据“C(金刚石)=C(石墨),△H= -1.896kJ·mol-1”,可以得出的正确结论是
| A.石墨的能量比金刚石低 | B.石墨和金刚石都是碳的同位素 |
| C.金刚石转变为石墨是物理变化 | D.金刚石比石墨更稳定 |
下列关于乙烯用途、性质、结构等描述不正确的是
| A.乙烯用途之一:可作为植物生长调节剂 | B.乙烯通入水中即可转化为乙醇 |
C.乙烯能够被酸性高锰酸钾溶液所氧化 |
D.乙烯分子中所有原子在同一个平面 |
已知氢元素有H、D、T三种同位素,氧元素有16O、17O、 18O三种同位素,则由它们构成的水分子的种类有多少种
A.27种 B.18种 C.12种 D.9种
已知aAn-、bBm-、cCm+、dDn+四种离子具有相同的核外电子排布,且n>m,则下列关系中正确的是
| A.得电子能力:A>B>C>D | B.元素的金属性:D>C>A>B |
| C.原子半径:D>C>B>A | D.离子半径:An->Bm->Cm+>Dn+ |
氢氧燃料电池的基本构造如图。A、B是多孔石墨制成,通入的气体由孔隙中逸出,在电极表面得失电子。电解质溶液是KOH溶液。下列关于该电池的说法中错误的是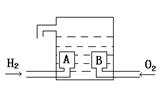
A.H2发生氧化反应 B.e-由B电极流向A电极
C.A电极为负极 D.每摩O2得到4mole-