据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示。
下列说法错误的是( )
| A.电池放电时Na+从a极区移向b极区 |
| B.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
C.该电池的负极反应为:BH +8OH--8e-=BO +8OH--8e-=BO +6H2O +6H2O |
| D.每消耗3 mol H2O2,转移的电子为3 mol |
在一 可变容积的密闭容器中进行反应:C(s) + H2O(g)
可变容积的密闭容器中进行反应:C(s) + H2O(g)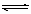 CO(g) + H2(g),下列条件的改变对反
CO(g) + H2(g),下列条件的改变对反 应速率几乎无影响的是
应速率几乎无影响的是
| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2,使体系的压强增大 |
| D.保持压强不变,充入N2,使容器的体积变大 |
以NA代表阿伏加德罗常数,则关于热化学方程式 C2H2 ( g ) +5/2O2 ( g ) = 2CO2 ( g )+H2O ( l )△H =" —1300kJ" / mol 的说法中,正确的是
| A.当10 NA个电子转移时,该反应放出1300kJ的能量 |
| B.当1 NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.当8 NA个碳氧共用电子对生成时,放出1300kJ的能量 |
已知反应A2(g)+2B2(g) 2AB2(g) △H<0,下列说法正确的是:
2AB2(g) △H<0,下列说法正确的是:
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,降低温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
已知热化学方程式2H2(g)+O2(g)=2H2O(l)△H1<0;2H2O(g)=2H2(g)+O2(g)△H2。下列说法正确的是
| A.方程式中化学计量数表示分子数 | B.△H2>0 |
| C.△H2=-△H1 | D.利用△H1、△H2可求出水的气化热 |
已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
| A.-317.3kJ·mol-1 | B.-379.3kJ·mol-1 | C.-332.8kJ·mol-1 | D.+317.3kJ·mol-1 |