下列离子方程式书写正确的是
| A.亚硫酸钠溶液加入稀硝酸:SO32-+2H+= SO2↑+H2O |
| B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为
| A.6A% | B.10A% | C.A/6% | D.(100-7A/6)% |
将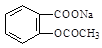 转变为
转变为 的方法为:
的方法为:
| A.与足量的NaOH溶液共热后,再通入CO2 | B.溶液加热,通入足量的HCl |
| C.与稀H2SO4共热后,加入足量的Na2CO3 | D.与稀H2SO4共热后,加入足量的NaOH |
现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液分离以上各混合液的正确方法依此是
| A.分液、萃取、蒸馏 | B.萃取、分液、蒸馏 |
| C.萃取、蒸馏、分液 | D.分液、蒸馏、萃取 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应: N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是 ()
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
下列物质中,既能与硫化氢反应又能使溴水褪色的是()
①硫化钾溶液②二氧化硫③硫酸铜溶液④硝酸银溶液⑤小苏打溶液⑥烧碱溶液
| A.①②③ | B.①②④⑤⑥ | C.③④⑤⑥ | D.②④⑥ |