相等物质的量的CO和CO2的下列比较中正确的是( )
①所含的分子数目之比为1:1 ②所含的O原子数目之比为1:2
③所含的原子总数目之比为2:3 ④所含的C原子数目之比为1:1
⑤它们的质量之比为7:11
| A.①② | B.②③ | C.④⑤ | D.①②③④⑤ |
在密闭容器中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
下列事实不能用勒夏特列原理解释的是
| A.将氯化铁晶体溶解于浓盐酸中配制氯化铁溶液 |
| B.温度升高,水的电离程度增大 |
| C.氯水中加入碳酸钙,漂白性增强 |
D.反应H2(g)+I2(g) 2HI(g)达平衡后,缩小反应容器体积,混合气体颜色变深 2HI(g)达平衡后,缩小反应容器体积,混合气体颜色变深 |
已知:A(g)+2B(g)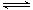 2C(g)△H = —Q kJ/mol (Q>0),在恒容的密闭容器中充入1molA和2molB,一定条件下发生反应。下列有关说法正确的是
2C(g)△H = —Q kJ/mol (Q>0),在恒容的密闭容器中充入1molA和2molB,一定条件下发生反应。下列有关说法正确的是
| A.平衡前,随着反应的进行,容器内气体密度逐渐减小 |
| B.平衡时,该反应放出的热量为QkJ |
| C.平衡后,再向容器中通人1mol氦气,A的转化率增大 |
| D.平衡后,缩小容器体积,A的浓度增大 |
在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应:2R(g)+5Q(g)  4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
| A.2 | B.3 | C.4 | D.5 |
在一密闭容器中,反应aA(g)  bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是
| A.a>b | B.平衡向正反应方向移动 |
| C.A的转化率减小 | D.B的质量分数减小 |