(每空1分,共15分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)0.2 mol NH3气体中含的NH3分子数是 ,其中含氢原子数是 ,含有电子的物质的量是 .
(2)1摩尔Ba(OH)2固体中含有的Ba2+的个数是 ,全部溶于水,电离产生的OH-的物质的量是 mol,通入二氧化碳气体,恰好完全反应,消耗的二氧化碳的物质的量是 摩尔。
(3)H2SO4的摩尔质量是 ,49gH2SO4中含有 mol氧原子,含有氢的质量是 。能与 摩尔NaOH恰好完全反应,生成水的质量是 克。
(4)含有6.02×1023个氧原子的H3PO4的物质的量是_________
(5)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______(用分式表示)
(6)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为__________________
(7)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是_______________
X,Y,Z,W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y﹑W均相邻,Y﹑Z和W三种元素的原子最外层电子数之和为17,且Z﹑W最外层电子数相同则:(每小题2分,共4分)
(1)用电子式表示X与Y所组成化合物的形成过程
(2)W在周期表中的位置是
(3)已知,在101kPa时,X单质在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,则表示X单质燃烧热的热化学方程式为__________。
写出下列物质的电子式:(每小题1分,共4分)
(1)硫化氢:氧气:
(2)氯化铵:过氧化钠:
从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应。试回答:
(1)反应和属于取代反应。
(2)化合物的结构简式:B,C
(3)反应④所用试剂和条件是
(4)反应②的方程式是
反应⑤的方程式是
(6分)某芳香族化合物的分子式为C7H8O,根据下列实验现象确定其结构简式:
(要求:每小题只需给出一个答案即可。)
①不能与金属钠反应,其结构简式______________________________。
②能与钠反应,但遇FeCl3不显色______________________________。
③能与钠反应且遇FeCl3显紫色_________________ ______________。
______________。
(6分)有人设想合成具有以下结构的烃分子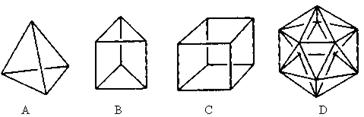
(1)结构D显然是不可能合成的,原因是
2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷。则金刚烷的
分子式为
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交
替排列的事实是()
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的
 键长均相等 d.能发生取代反应和加成反应
键长均相等 d.能发生取代反应和加成反应
(4)C的一种属于芳香烃的同分异 构体是生产某塑料的单体,写出其加聚合成该塑料的化学方程式
构体是生产某塑料的单体,写出其加聚合成该塑料的化学方程式