利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
| A.降低温度 |
| B.增大压强同时加催化剂 |
| C.升高温度同时充入N2 |
| D.及时将CO2和N2从反应体系中移走 |
用惰性电极电解足量下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是
| A.CuCl2 [CuCl2溶液] | B.NaOH [NaOH溶液] |
| C.NaCl [HCl气体] | D.CuSO4 [Cu(OH)2] |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-==3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |
乙苯催化脱氢制苯乙烯反应: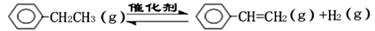
已知:1 mol C-H键完全断裂时吸收热量412kJ,1 mol C-C键完全断裂时吸收热量348kJ
1 mol C=C键完全断裂吸收热量612kJ,1 mol H-H键完全断裂时吸收热量436kJ。
上述反应的△H等于kJ·mol-1。
| A.-124 | B.+124 | C.-288 | D.+288 |
下列说法正确的是:
| A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g)ΔH=-38.6kJ·mol-1 2NH3(g)ΔH=-38.6kJ·mol-1 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同 |
| D.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |
下列说法正确的是
A.已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色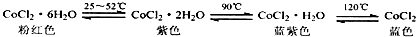 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
| C.2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0 |
| D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |