在25℃、101KPa下,1g甲醇燃烧生成CO2和液态水时放热22.68KJ,
下列热化学方程正确的是 ( )
A.CH3OH(l)+ O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452KJ/mol |
C.CH3OH(l)+ O2(g)=CO2(g)+2H2O(g) ΔH="-725.8KJ/mol" O2(g)=CO2(g)+2H2O(g) ΔH="-725.8KJ/mol" |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1452KJ/mol |
下图为元素周期表中短周期的一部分,下列说法正确的是
| ① |
② |
③ |
| ④ |
⑤ |
⑥ |
A.①~⑥可能全部是非金属元素
B.对应单质的活泼性:②>③
C.④的最高价氧化物对应的水化物可能为两性物质
D.②、⑤的最高价氧化物对应的水化物可能均为强酸
有关下列溶液的叙述正确的是
| A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: |
n(K+) = n(S2-)+n(HS-)+n(H2S) = 1mol
下列实验操作不正确的是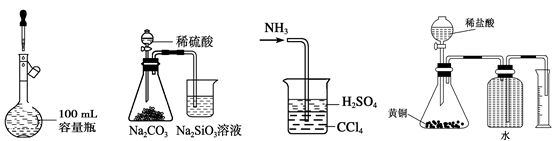
A. B. C. D. A.定容
A.定容
B.比较硫、碳、硅三种元素的非金属性强弱
C.处理尾气
D.测定黄铜(Cu、Zn合金) 中Zn的含量
某有机物的分子结构如图(图中棍表示单键、双键或叁键),它属烃的含氧衍生物。关于该有机物的叙述正确的是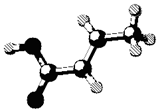
| A.该有机物的化学式为C6H6 |
| B.该有机物可发生取代反应和加成反应 |
| C.该有机物可使溴水褪色,但不能与NaOH溶液反应 |
| D.该有机物是乙酸的同系物 |
下列离子方程式正确的是
| A.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2 = NO+2NO↑+H2O |
B.NH4HCO3溶液与足量KOH浓溶液共热:NH+OH-  NH3↑+H2O NH3↑+H2O |
| C.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO= 3Fe2++2NO↑+4H2O |
| D.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2O |