管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的天然气,
理论上所获得的热值,前者大约是后者的多少倍( )
| A.0.8 | B.1.3 | C.3.1 | D.0.32 |
用惰性电极实现电解,下列说法正确的是( )
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
B.电解稀氢氧化钠溶液,要消耗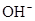 ,故溶液pH减小 ,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
人们使用四百万只象鼻虫和它们的215磅粪物,历经30多年时间弄清了棉子象鼻虫的四种信息素的组成,它们的结构可表示如下(括号内表示④的结构简式)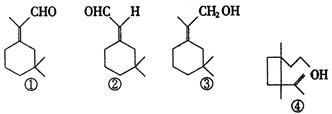
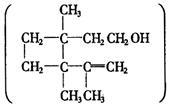
以上四种信息素中互为同分异构体的是:( )
| A.①和② | B.①和③ |
| C.③和④ | D.②和④ |
能正确表示下列化学反应的离子方程式是( )
A.用碳酸钠溶液吸收少量二氧化硫: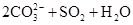  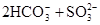 |
B.金属铝溶于盐酸中: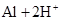  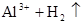 |
C.硫化钠溶于水中: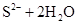  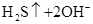 |
D.碳酸镁溶于硝酸中: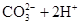  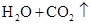 |
对某酸性溶液(可能含有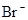 ,
,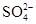 ,
,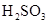 ,
,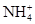 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入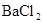 溶液,产生的白色沉淀不溶于稀硝酸.对于下列物质不能确认其在原溶液中是否存在的是( )
溶液,产生的白色沉淀不溶于稀硝酸.对于下列物质不能确认其在原溶液中是否存在的是( )
A.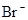 |
B.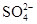 |
C.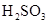 |
D.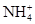 |
若溶液中由水电离产生的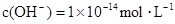 ,满足此条件的溶液中一定可以大量共存的离子组是( )
,满足此条件的溶液中一定可以大量共存的离子组是( )
A.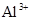 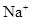 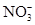 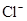 |
B.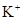 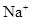 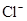 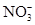 |
C.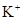 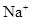 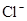 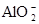 |
D.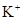 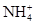 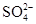 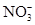 |