水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14, K(35℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14, K(35℃)=2.1×10-14。则下列叙述正确的是( )
| A.c(H+)随着温度升高而降低 | B.35℃时,c(H+)>c(OH-) |
C.水的电离度 > > |
D.水的电离是吸热的 |
已知G的分子结构模型如右图所示(图中球与球之间连线表示单键或双键),用芳香
烃A为原料合成G的路线如下:

试回答下列问题:
(1)G的结构简式为,G的一种同分异构体的结构简式为。
(2)化合物E中的含氧官能团有(填名称)。
(3)A→B的反应类型是,E→F的反应类型是。
(4)书写化学方程式
C→D
E→H
下列反应的离子方程式正确的是
A.硫化亚铁中加入稀硫酸 2H++S2-→H2S↑  |
B.向苯酚钠溶液中通入少量的CO2-O-+CO2+H2O→-OH+HCO |
C.向碳酸氢钠溶液中滴入少量石灰水 HCO +Ca2++OH-→CaCO3↓+H2O +Ca2++OH-→CaCO3↓+H2O |
|
D.向明矾溶液中加入过量的氨水 A13++3NH3·H2O→Al(OH)3↓+3NH |
用NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA |
| B.标准状况下,2.24L乙烷含有的化学键总数为0.8NA |
| C.常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA |
| D.标准状况下,22.4L甲醇中含有的氧原子数为NA |
加入铝粉能放出H2的溶液中肯定不能大量共存的离子组是
A. Fe3+、NO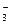 、Cl-、NH
、Cl-、NH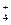 B.Ba2+、Mg2+、NO
B.Ba2+、Mg2+、NO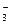 、Cl-
、Cl-
C.SO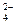 、Cl-、K+、NH
、Cl-、K+、NH D.SO
D.SO 、K+、AlO
、K+、AlO 、Na+
、Na+
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质,5-羧基荧光素(5-FAM)
结构简式如右图所示,在碱性条件下有强烈的绿色荧光,广泛
应用于荧光分析等。下列有关5-FAM说法不正确的是
| A.可与碳酸氢钠溶液反应 |
| B.分子式为C21H12O7 |
| C.1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠 |
| D.不与FeCl3发生反应 |