2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) =PCl5(g),达平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3 和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A.0.40mol | B.小于0.20mol |
| C.0.20mol | D.大于0.20mol,小于0.40mol |
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是()
| A.35.5a=(W2-W1)V2 | B.n(Al)>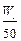 mol mol |
C.n(Na)+3n(Al)=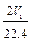 mol mol |
D. aV2=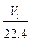 |
在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推知该溶液中()
| A.一定含有I-,不能确定是否含有Cl- |
| B.一定含有NO3- |
| C.不含有Fe3+,可能含有NO3- |
| D.一定含有I-、NO3-和Cl- |
经测定某溶液中只含有Na+、CH3COO—、H+、OH—四 种离子,且离子浓度大小顺序
种离子,且离子浓度大小顺序
为c(CH3COO—)>c(Na+) >c(H+) >c(OH—),其可能的情形是()
| A.该溶液是CH3COONa和CH3COOH的混合溶液 |
B.该溶液 是CH3COONa溶液 是CH3COONa溶液 |
| C.该溶液是CH3COONa和NaOH的混合溶液 |
| D.向该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为: |
c(CH3COO—)>c(Na+) >c(OH—) >c(H+)
已知化学反应N2+ O2=2NO的能量变化如图所示,判断下列叙述中正确的是()
| A.该反应为放热反应 |
| B.该反应每生成2 mol NO,吸收b kJ热量 |
| C.该反应中反应物的总能量高于生成物的总能量 |
D.该反应吸收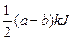 热量时,参加反应的O2为0.5 mol 热量时,参加反应的O2为0.5 mol |
下列叙述正确的是()
| A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入NaNO3固体,铜粉仍不溶 |
| C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变 |