X、Y是周期表前二十号元素,已知X、Y之间原子序数相差3,X、Y能形成化合物M。下列说法不正确的是
| A.若X、Y处于同一周期,则化合物M不可能是正四面体型分子 |
| B.若X的单质常温下是气体,则Y的单质常温下也是气体 |
| C.若X、Y两元素周期数差1,则属于离子化合物的M只有四种 |
| D.若M属于离子化合物,则其中可能含有非极性键 |
下图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
| A.该硫酸试剂可以做干燥剂,干燥任何气体 |
| B.该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| C.配制200mL 4.6mol·L-1的稀硫酸需取该硫酸50.0mL |
| D.常温下,2.7gAl与足量的稀硫酸反应得到H2 3.36L |
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,则M可能是
| A.Al3+ | B.Mg2+ | C.Cl- | D.Ba2+ |
已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的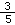 倍,下列叙述中正确的是
倍,下列叙述中正确的是
| A.溶液中一定有1molNa2SO4和3molNaCl |
B.所带电荷数SO42-是Na+的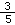 倍 倍 |
| C.SO42-与Cl-的物质的量之和等于Na+的物质的量 |
| D.Na2SO4和NaCl的物质的量之比为1:3 |
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
① 2Sb2S3+3O2+6Fe=Sb4O6+6FeS ②Sb4O6+6C=4Sb+6CO。关于反应①、②的说法正确的是
A.反应①②中的氧化剂分别是Sb2S 3、Sb4O6 3、Sb4O6 |
| B.反应①中每生成3 mol FeS时,共转移6 mol电子 |
| C.反应②说明高温下Sb的还原性比C强 |
| D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3 |
能正确表示下列化学反应的离子方程式的是
| A.氢氧化钡溶液与硫酸反应Ba2++OH-+H++SO42-=BaSO4↓+ H2O |
| B.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C.铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |