同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是:
| A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2 |
| B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2 |
| C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2 |
| D.所含的电子数由多到少是:CO2>SO2>CH4>O2>H2 |
有反应4HCl+O2→2Cl2+2H2O,已知2molO2被还原时,放出a kJ的热量,且知断开1molO2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl 键所需能量高
| A.(a+b-2c)/4 | B.(a+2b-4c)/8 | C.(b-a-2c)/4 | D.(2b-a-4c)/8 |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系下表:
| 温度℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法正确的是
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是
| A.若W是强氧化性的单质,则X可能是金属铝 |
| B.若W是氢氧化钠,则X水溶液为酸性 |
| C.若W是单质铁,则Z溶液可能是FeCl2溶液 |
| D.若W是氧气,则X、Z的相对分子质量可能相差48 |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
| A.ω=35a/(22.4Vρ) |
| B.c =a/(22.4V)mol/L |
| C.等浓度等体积的上述氨水和氢氧化钠溶液分别与等体积等浓度的稀盐酸反应,两者放出的热量相等 |
| D.在氨水中存在分子间作用力、氢键、共价键 |
下列图像表达正确的是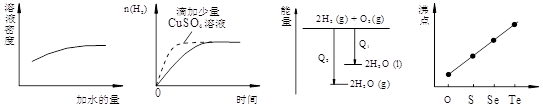
| A.稀硫酸的稀释 |
B.等量的盐酸与过量的锌粉反应 |
C.氢气与氧气反应中的能量变化 |
D.气态氢化物沸点 |