将0.1mol·L-1K2SO4溶液、0.2mol·L-1Fe2(SO4)3溶液与水混合,欲使混合溶液中K+、Fe3+、SO42-物质的量浓度为0.1mol·L-1、0.1mol·L-1、0.2mol·L-1,则所用的K2SO4溶液,Fe2(SO4)3溶液、水的体积比约为:
| A.1:1:1 | B.2:1:1 | C.1:1:2 | D.2:1:2 |
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是()。
| A.sp,范德华力 | B.sp2,范德华力 |
| C.sp2,氢键 | D.sp3,氢键 |
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是()。
A.NH4Cl NH3↑+HCl↑ NH3↑+HCl↑ |
| B.NH3+CO2+H2O=NH4HCO3 |
| C.2NaOH+Cl2=NaCl+NaClO+H2O |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
有五种元素X、Y、Z、Q、T。X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是()。
| A.元素Y和Q可形成一种化合物Y2O3 |
| B.T和Z各有一种单质的空间构型为正四面体形 |
| C.X和Q结合生成的化合物为离子化合物 |
| D.ZO2是极性键构成的非极性分子 |
下列说法中正确的是()。
| A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子 |
| B.NH3、H2O、CH4分子的几何构型均为三角锥形 |
| C.NH3、H2O、CH4分子中的N、O、C原子均是采取sp2杂化的 |
| D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中,不正确的是()。
| A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体 |
C.NH5的电子式为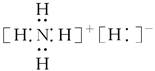 |
| D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |