核糖是合成核酸的重要原料,结构简式为CH2OH-CHOH-CHOH-CHPH―CHO,下列关于核糖的叙述正确的是( )
| A.与葡萄糖互为同系物 | B.可以与银氨溶液作用形成银镜 |
| C.可以跟氯化铁溶液作用显色 | D.可以使紫色石蕊试液变红 |
室温时,下列混合溶液的pH一定小于7的是
| A.pH=4的盐酸和pH=10的氨水等体积混合 |
| B.pH=2的盐酸和pH=13的氢氧化钡等体积混合 |
| C.pH=5的醋酸和pH=9的氢氧化钡等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
在-50 ℃时液氨中有2NH3(液)  NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
| A.电离平衡常数是1×10-15 |
| B.不加入其他物质,液氨中c(NH4+)=c(NH2—) |
| C.降低温度,其电离平衡常数数值增加 |
| D.此液氨中放入NH4Cl,其电离平衡常数的数值增加 |
用0.01 mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4;(设1滴为0.05ml)则①和②c(H+)的比值是
| A.10 | B.50 | C.5×103 | D.104 |
可逆反应mA(g) nB(g)+pC(s);△H="Q," 温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像,以下叙述正确的是
nB(g)+pC(s);△H="Q," 温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像,以下叙述正确的是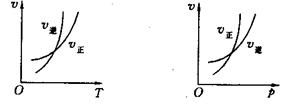
| A.m>n,Q>0 | B.m>n+p,Q>0 | C.m>n,Q<0 | D.m<n+p,Q<0 |
在一定温度下发生反应:I2(g)+H2(g) 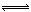 2HI(g);△H<0并达平衡。HI的体积分数
2HI(g);△H<0并达平衡。HI的体积分数 随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下
随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下 的变化如曲线(I)所示。在乙条件下
的变化如曲线(I)所示。在乙条件下 的变化如曲线(III)所示。则甲条件、乙条件分别是
的变化如曲线(III)所示。则甲条件、乙条件分别是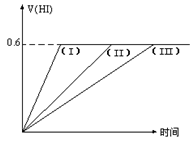
①恒容条件下,升高温度②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当的催化剂
| A.①⑤,③ | B.②⑤,④ | C.③⑤,② | D.③⑤,④ |