设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
| A.10 g氖气中所含的原子数为NA |
| B.0.5 NA个Cl2分子的物质的量是3.01×1023mol。 |
| C.标准状况下,将22.4 L氯化氢气体溶于足量水中,溶液中含有的氯化氢分子数为NA |
| D.9 g水含有的电子数为5 NA |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l);电解池:2Al + 3H2O Al2O3 + 3H2↑,电解过程中,以下判断正确的是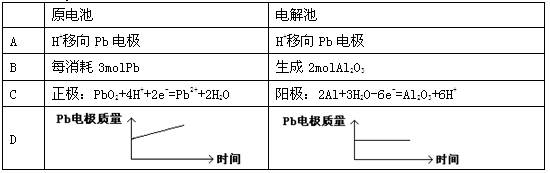
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn - MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |