用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )
| 选项 |
气体 |
a |
b |
c |
d |
| A |
CO2 |
盐酸 |
CaCO3 |
饱和Na2CO3溶液 |
浓硫酸 |
| B |
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 |
| C |
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
| D |
NO |
稀硝酸 |
铜屑 |
H2O |
浓硫酸 |
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲 线如右图所示。下列说法正确的是()
线如右图所示。下列说法正确的是()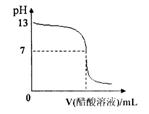
| A.pH=7时,所加醋酸溶液的体积为10mL |
| B.pH<7时,溶液中c(CH3COO-)>c(Na+) |
| C.7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
D.继续滴加0.1 mol·L -1醋酸溶液,溶液pH可以变为1 -1醋酸溶液,溶液pH可以变为1 |
下表中的实验操作能达至实验目的或得出相应结论的是()
| 选项 |
实验操作 |
实验目的或结论 |
| A |
向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加0.01mol·L-1NaCl溶液,至不再有沉淀生成,再向其中滴加 0.01mol·L-1Nal溶液,产生黄色沉淀。 |
常温下,Ksp(AgCl)>Ksp(Agl) |
| B |
C2H5Br与NaOH溶液混合充分振荡,再加入AgNO3溶液 |
检验C2H5Br中的溴元素 |
| C |
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 |
说明溶液中一定含有Fe2+ |
| D |
将少量某物质滴加到新制的氢氧化铜悬浊液中,加热后有红色沉淀生成 |
说明该物质一定是醛 |
下列实验装置和操作正确的是()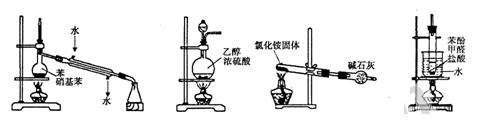
| A.分离苯和硝基苯 | B.制取乙烯 |
| C.制取氨气 | D.制备酚醛树脂 |
常温下,下列各组离子在指定溶液中能大量共存的是()
| A.无色透明的溶液中:MnO4、SO42-、K+、Fe2+ |
| B.pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ |
| C.c(SO32-)=0.5 mol·L-1的溶液中:ClO-、Na+、Cl-、CO32- |
| D.水电离产生的c(H+)=1×10-14mol·L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
设nA为阿伏加德罗常数的值,下列叙述正确的是()
| A.常温常压下,16g14CH4所含中子数目为8nA |
| B.标准状况下,22.4 LCCl4所含分子数目为nA |
| C.1 L 0.5 mol·L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5n |
| D.6.2g白磷(分子式为P4,分子结构如右图所示)所含P-键数目为0.3nA |
