理论上不能用于设计成原电池的反应是
| A.2H2(g)+O2(g)==2H2O(l)△H<0 |
| B.HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l)△H<0 |
| C.2Al(s)+3Cl2(g)==2AlCl3(s)△H<0 |
| D.Zn(s)+2HCl(aq)==ZnCl2+H2(g)△H<0 |
下列图示与对应的叙述相符的是()
| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线 |
| C.图Ⅲ表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图Ⅳ表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。
下列有关说法正确的是()
| A.在工段③和⑤中需要用到氯碱工业的产物 |
| B.工段②中的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.大量的含Fe3+废水排人海洋,易引发赤潮 |
| D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液一过滤后加盐酸 |
用NA表示阿伏加德罗常数,下列叙述正确的是()
| A.1mol Cl2与足量的铁反应,转移的电子数为3NA |
| B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| C.3.4gH2O2中含有的共用电子对数为0.1NA |
| D.标准状况下,lmol SO3含有的氧原子数为3NA |
下列有关实验原理或实验操作正确的是()
| A.用pH试纸测定氯水的pH |
| B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌 |
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2 |
| D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚 |
下列表示对应化学反应的离子方程式正确的是()
| A.漂白粉溶液中通入过量二氧化碳: Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| B.NaOH溶液中滴人饱和FeCl3溶液: Fe3++3H2O 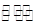 3H++3Fe(OH)3(胶体) 3H++3Fe(OH)3(胶体) |
C.将氯气溶于水配制氯水:Cl2+H2O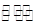 H++Cl-+HClO H++Cl-+HClO |
| D.用硫酸酸化的KMnO4溶液与H2O2反应: |
2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O