高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH- 3H2↑+FeO
3H2↑+FeO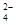 。下列说法正确的是
。下列说法正确的是
| A.铁为阳极,H2SO4为电解液 |
| B.铁为阴极,浓NaOH为电解液 |
C.阳极发生的电极反应为Fe+8OH--6e-===4H2O+FeO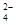 |
| D.铁失去3 mol电子可以在阴极得到33.6 L氢气 |
下列各表述与示意图不一致的是
A.图①表示向含Mg2+、Al3+、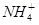 的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n( 的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n(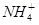 )=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。 )=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。 |
| B.图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,△H<0,若使用正催化剂,E值会减小。 |
| C.图③可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
| D.图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(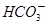 )的值保持增大
)的值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(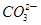 )+c(
)+c(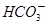 )]
)]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
④向0.1mol·L-1(NH4)2SO3溶液中加入少量NaOH固体,c(Na+)、c( )、c(
)、c(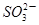 )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-)
| A.①④ | B.②④ | C.①③ | D.②⑤ |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2) :n(NO)=1 :1时,下列说法不正确的是
| A.反应中Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化产物 |
| B.参加反应的n(Cu2S) :n(HNO3)=1 :7 |
| C.产物n[Cu(NO3)2] :n[CuSO4]=1 :2 |
| D.1 molCu2S参加反应时有10 mol电子转移 |
双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是
| A.a气体为氢气,b气体为氧气 |
| B.A溶液为氢氧化钠,B溶液为硫酸 |
| C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜 |
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑ 2H2SO4+4NaOH+O2↑+2H2↑ |
短周期元素X、Y、Z、W、U原子序数依次递增。X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13。Y元素的单质在X的某种氧化物中可燃。下列说法正确的是
| A.X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X |
| B.Y、Z元素的单质作电极,在NaOH溶液中构成原电池,Z电极上产生大量气泡 |
| C.室温下,0.05 mol·L-1 U的气态氢化物的水溶液的pH>1 |
| D.Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |