(14分)如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。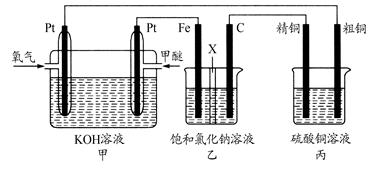
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为______ ___ __,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为____ ____;丙装置中阴极析出铜的质量为____ ___ _。
⑴键线式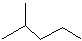 表示的分子式;名称是。
表示的分子式;名称是。
⑵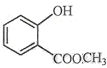 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶写出丁基的4种同分异构体_________________________。
⑷含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_____ _ ___、__________、尾接管、锥形瓶。
(共12分)化合物A是最早发现酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。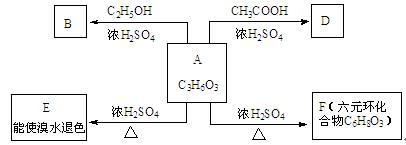
(1)A: B: D:
(2)化学方程式:A ® E
A ® F
(3)反应类型:A ® E _____________________ , A ® F ____________________。
根据下面的反应路线及所给信息填空: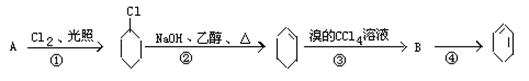
(1) A的结构简式是;
(2) ①的反应类型,②的反应类型,
③的反应类型;
(3) 反应③的化学方程式:;
反应④的化学方程式:。
(共12分)写出下列反应的化学方程式
(1)乙烯的水化
(2)丙烯的加聚反应
(3)苯的溴代
(4)甲苯的硝化
(5)二丙醇的氧化反应
(6)乙烯的实验室制取原理
(1)写出下列微粒的电子式:
①CH 3- ②-OH ③C 2H 2 ④OH -
(2)命名