下列实验操作中,错误的是( )
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.把几滴FeCl3饱和溶液滴入25mL沸水中制备Fe(OH)3胶体 |
| C.过滤可以除掉粗盐中可溶于水的杂质 |
| D.碘易溶于有机溶剂,可用CCl4萃取碘水中的碘 |
下列说法中正确的是
A.聚合硫酸铁可用于净水,其化学式为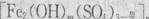 ,式中的m可能为6 ,式中的m可能为6 |
| B.将3g白色粉未完全溶于10g热水中冷却至室温析出2g晶体,再将析出的2g晶体全部溶于10 g热水中,冷却至室温析出1.5 g晶体。由此可知此白色粉末可能是纯净物也可能是混合物 |
| C.无色混合气体甲依次经过下图所示实验装置的处理,结果得到酸性溶液且最终无气体剩余.则原气体的成分可能为NH3、NO、CO2 |
| D.淀粉和纤维素的组成都是(C6H10O5)n,水解的最终产物都是葡萄糖,蛋白质是由氨基酸形成的可降解的高分子化合物 |
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )
| A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等 |
| B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等 |
| C.一定条件下,两种物质都能发生酯化反应和氧化反应 |
| D.鞣酸分子中,可能在同一平面上的原子最多有14个 |

根据右图所示的装置(甲中电极均为惰性电极)判断下列叙述中正确的是 ( )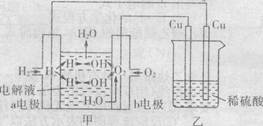
| A.甲是一种具有应用前景的绿色电源 |
| B.甲中b电极的电极反应为:40H-一4e=2H20+02↑ |
C.通电初期乙中的总反应为:Cu + H2SO4 |
| D.反应过程中甲、乙装置的pH都逐渐减小 |
设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
| A.12g镁在空气中完全燃烧失去的电子数为NA |
| B.用粗铜作阳极电解稀硫酸,当生成0.1molH2时,阳极失去的电子数为0.1 NA |
| C.标准状况下,22.4LSO3所含的分子数约为NA |
| D.有1 molCH3COO-的醋酸钠溶液中Na+数目等于NA |
已知A~G都是中学化学中的常见物质,其中A是固体单质,C 是气体单质,E是氧化物,它们之间的转化关系如右图所示(图中部分产物及反应条件没有列出)。据此判断下列说法正确的是( )
| A.A一定是金属,C一定是氧气 |
| B.A一定是非金属,B可能是NaOH |
| C.在通常情况下,物质E的熔点可能很高 |
| D.图中所涉及的反应只有置换反应、复分解反应 |