下列仪器常用于物质分离的是
| A.①③⑤ | B.②③⑤ | C.②④⑤ | D.①②⑥ |
某固体酸燃料电池以
固体为电解质传递
,其基本结构见下图,电池总反应可表示为:
,下列有关说法正确的是
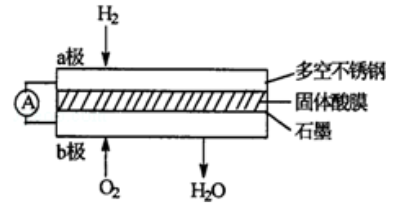
| A. | 电子通过外电路从 极流向 极 |
| B. | 极上的电极反应式为: |
| C. | 每转移0.1 电子,消耗1.12 的 |
| D. | 由 极通过固体酸电解质传递到 极 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
在恒容的密闭容器中,下列有关说法正确的是()
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B. | 平衡时,其他条件不变,增加 的浓度,废气中氮氧化物的转化率减小 |
| C. | 单位时间内消耗 和 的物质的量比为1:2时,反应达到平衡 |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
下列实验操作或装置符合实验要求的是()
| A. |
|
B. |
|
| C. |
|
D. |
|
亚氨基锂(
)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
 ,下列有关说法正确的是
,下列有关说法正确的是
| A. |
中
的化合价是 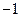 |
B. | 该反应中 既是氧化剂又是还原剂 |
| C. | 和 的离子半径相等 | D. | 此法储氢和钢瓶储氢的原理相同 |
在 1的溶液中,能大量共存的一组离子或分子是
| A. | 、 、 、 | B. | 、 、 、 |
| C. | 、 、 、 | D. | 、 、 、 |