已知A、B、C、D四种物质具有以下物理性质:
| |
A |
B |
C |
D |
| 分散到水中 |
得悬浊液 |
得无色溶液 |
液体分层,且下层为无色油状液体 |
得无色溶液 |
| 熔点(℃) |
1452 |
-21.3 |
-11.5 |
801 |
| 沸点(℃) |
1703 |
78.9 |
117 |
1210 |
(1)已知A与D不发生反应,且均不与水反应。
①.欲从A、D的混合物中分离提纯D,需进行的操作是:
a:溶解;b: (填操作名称,下同);c: 。
②上述a、b、c操作过程中均需用到的一种玻璃仪器为_____;从B的水溶液中分离出B的操作名称为 。
(3)从C与水的混合物中分离提纯C所需的玻璃仪器有_______
(12分)从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。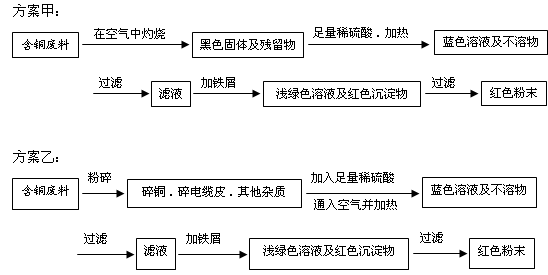
(1)两个方案中,符合当前生产中绿色化学理念的是方案。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a-1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00 mol·L-1的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
计算上述样品中CuCl的质量分数。(写出计算过程)
(1)某课外活动小组同学用下图装置进行实验
试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为。
(2)芒硝化学式为Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如下图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因:。
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为,已知H2的燃烧热为285.8 kJ·mol-1,则该燃料电池工作产生36 g H2O时,理论上有kJ的能量转化为电能。
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。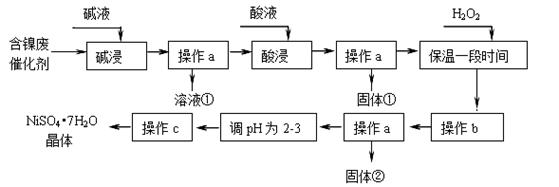
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)操作c中需使用的仪器除铁架台(带铁圈)、酒精灯、玻璃棒外还需要的主要仪器为。
(2)“碱浸”过程中发生的离子方程式是,。
(3)“酸浸”时所加入的酸是(填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是。
(5)“调pH为2~3”的目的是。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是。
(14分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。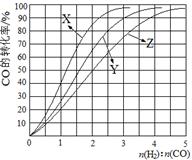
230℃的实验结果所对应的曲线是(填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是(填字母) 。
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正)v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将(填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
①该电池工作时,OH-向极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为。
工业上生产高氯酸(沸点:90oC)时还生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的是降低NaHSO4的,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为,SO2的作用是作剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较(填“高”或“低”),容易从溶液中逸出,循环使用的物质是。