(16分) Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1) S2O32-能被I2氧化为S4O62-;(2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ. 市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2: |
|
| 步骤3: |
|
Ⅱ. 利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0gNa2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL0.01mol·L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2=S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2)完成并配平步骤②中的离子反应: Cr2O72-+ ( )+ I- ="=" I2 + Cr3++ H2O。
(3)步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。(Na2S2O3的摩尔质量为158g·mol-1)。
用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________________________________。
(2)除去蒸馏水中溶解的O2常采用的方法是_______________________________________。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____________________________________
_______________________________________________________________________________。
方法二:在如下图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。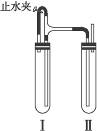
(1)在试管Ⅰ里加入的试剂是___________________。
(2)在试管Ⅱ里加入的试剂是___________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_______________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________
_______________________________________________________________________________。
右图中所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。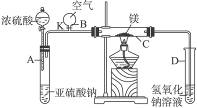
(1)C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为___________________
______________________________________________________________________________。
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯,橡胶气胆B在实验中的作用是______________________________________________________________________________。
(3)C中全部反应产物有______________、______________、______________。(填化学式)
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:800 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19 g·mol-1)、水。按如图所示装置进行实验,完成下列问题(设合金样品完全反应,产生的气体体积不超过100 mL)。
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称最后的合金样品用铜网小心包裹好,放在100 mL烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是:_____________。
在硝酸铅[Pb(NO3)2]的稀溶液中滴入几滴稀硫酸,生成白色PbSO4沉淀,再滴入数滴饱和醋酸钠溶液,微热并不断搅动,沉淀慢慢溶解.以上发生的都是复分解反应,写出反应过程的离子方程式、,试推测第二步离子反应发生的原因是
长期烧水的壶内侧会有一层黄色的固体物质附着,即水垢[主要成分是CaCO3和Mg(OH)2].水垢的产生会造成传热能力减弱而使大量热损失,因此水垢应定期除去.请用家中必备物质设计一套除垢方案,并写出涉及的离子方程式。