常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.1 mol·L-1 NaOH溶液中:K+、Na+、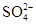 、 、 |
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、Ba2+、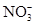 、Cl- 、Cl- |
C.在0.1 mol·L-1 FeCl3溶液中:K+、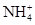 、I-、SCN- 、I-、SCN- |
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、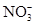 |
下列叙述正确的是
| A.0.1mol/L醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 |
| D.NaHCO3溶液中:c(Na+)>c(H2CO3)>c(HCO3-) |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=11的溶液中:CO32-、Na+、AlO2-、NO3- |
| B.加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、NH4+ |
| C.无色溶液中:K+、Al3+、NO3-、HCO3- |
| D.滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- |
关于下列各装置图的叙述中,不正确的是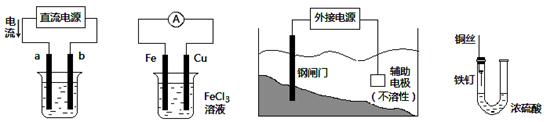
①②③④
| A.用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是
| A.K37ClO3与浓HCl在加热条件下生成Cl2的化学方程式: K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O |
B.表示H2燃烧热的热化学方程式: H2(g)+ O2(g)=H2O(g)△H= -241.8KJ/mol O2(g)=H2O(g)△H= -241.8KJ/mol |
| C.将1~2ml FeCl3饱和溶液滴入到20ml沸水中所发生的离子方程式: Fe3++3H2O 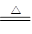 Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
D.电解氯化钠溶液:2Cl—+2H+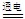 Cl2↑+H2↑ Cl2↑+H2↑ |
下列实验操作与预期目的或所得结论一致的是