某固体氯化铁中混有氯化亚铁,为测定其中铁的质量分数,现进行如下实验: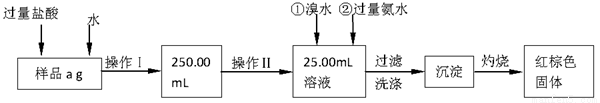
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有 。(填仪器名称)
(2)进行操作Ⅱ所选用的仪器是 。
| A.50ml量筒 | B.25ml量筒 | C.50ml碱式滴定管 | D.50ml酸式滴定管 |
(3)写出向该溶液中加入氯水和过量氨水时发生的离子方程式分别是 ,
(4)在过滤洗涤时,用什么方法证明沉淀已洗涤干净
(5)称量灼烧后所得固体为b1g,再灼烧再称量为b2g,若b1-b2=0.3g,某同学认为已符合要求,你认为是否符合要求,理由是什么 。
(6)若样品质量为ag,最后所得固体质量为bg,写出铁的质量分数表达式 (不用化简)。
(7)有人认为该实验中有一步操作是不必要的,请指出该步操作是 。
(8)若证明操作Ⅰ所得溶液中含有Fe3+,写出所需试剂的名称 。
邻羟基苯甲酸的结构式为 ,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸: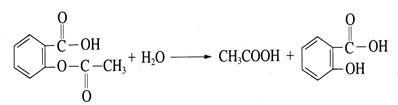
据此,请回答:
这个反应的反应类型为;
有时,生 产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是
产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是
。
写出以下化学方程式
(1)常见的疏松剂的疏松作用原理(用化学方程式表示)
碳酸氢钠: ;
;
(2)淀粉水解:;
(3)漂白粉的漂白原理(用化学方程式表示)。
若人体中缺少 以下各种元素之一,会出现各种症状,请找出之间对应的关系:缺乏维生素A ;缺乏维生素C ;缺钙;缺碘;缺氟;缺铁。
以下各种元素之一,会出现各种症状,请找出之间对应的关系:缺乏维生素A ;缺乏维生素C ;缺钙;缺碘;缺氟;缺铁。
症状:
| A.甲状腺肿大 | B.龋齿 | C.贫血 |
| D.夜盲症E.坏血病 F.佝偻病或骨质疏松 |
下边是温州城区2011年10月某日的空气质量日报
| 污染指数 |
首要污染物 |
空气污染指数 |
空气质量等级 |
||
| 二氧化硫 |
二氧化氮 |
可吸入颗粒物[ |
|||
| 55 |
78 |
56 |
良 |
(1)首要污染物是;
(2)空气污染指数是;
(3)能引起光化学烟雾的是(从表中选);
(4)能引起酸雨的是(从表中选)。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2 +、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下: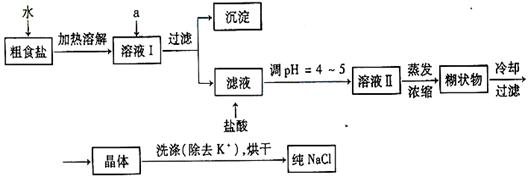 提供的试剂如下:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
提供的试剂如下:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的多种试剂,按滴加顺序依次为。(只填化学式)
(2)电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后(填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式。
(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4H Cl(浓)
Cl(浓)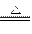 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
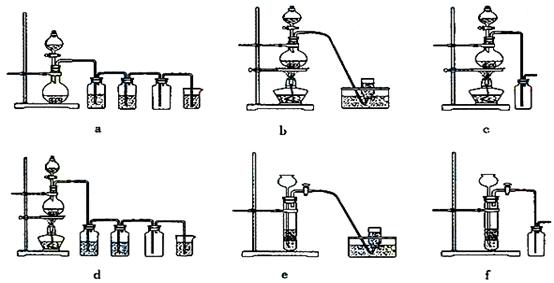
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置
(填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
(填代号)。