下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题: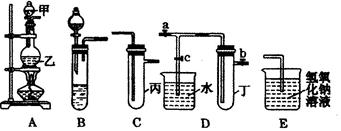
(1)将A、C、E相连后,以浓盐酸和 (填写名称)为原料制取Cl2,仪器乙的名称是 。
写出实验中制备氯气的离子方程式 。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验 序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将所得氯水滴入品红溶液 |
品红溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
向所得氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理? (填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由): 。
实验Ⅱ获得结论是否合理? (填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由): 。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是 。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先 ,再 以使烧杯中的水进入试管丁,观察现象。
某小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
(1)用下图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
反应一段时间,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式。
(2)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤。写出有关的化学方程式:
(3)向滤液中滴加KSCN溶液,观察到溶液的颜色有两种可能,如下表。在下表中填写与现象相对应的结论与解释(可以不填满)。
| 现象 |
结论与解释 |
|
| 可能① |
溶液由浅绿色变红色 |
|
| 可能② |
溶液仍然为浅绿色 |
(4)可能①中,若要使红色又变成浅绿色,又不增加其它的金属离子,可以加入,可能②中,加入 可以使溶液变成红色。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?___________。简述你的理由_____________________________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。
写出实验过程中发生反应的离子方程式_____________________、___________________________、________________________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________________。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)____________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,实验过程中所发生反应的化学方程式为____________________,______________________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)____________。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体应是(填化学式)_______。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为____________,请设计实验检验所得溶液中溶质的阴离子_________________________________________________________________。
某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
回答下列问题:
(1)滤渣的成分为____和____,(填化学式)操作①的名称为____。
(2)上图溶液B中所发生反应的离子方程式为 __________。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要____和____。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为___________,其作用是___________。
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是(填序号)。
(2)蒸发皿的使用:把滤液倒入蒸发皿中,再把蒸发皿放到铁架台的铁圈上。用酒精灯加热,同时用玻璃棒不断搅拌,以防止_______________。当蒸发皿里的液体较少时,则应___________,利用余热使剩余溶剂挥发。
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为,制取该气体利用了B的性质有、。通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为;
② 若在乙中收集氨气,气体流经装置的顺序是:a→→→d(填接口代号)。
(4)下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有(填写编号)。