下列实验过程中,始终无明显现象的是
| A.CO2通入饱和碳酸钠溶液中 |
| B.在稀硫酸中加入铜粉,再加入KNO3固体 |
| C.NO2通入FeSO4溶液中 |
| D.SO 2通入饱和CaCl2溶液中 |
向含等物质的量两种溶质的甲溶液逐渐加人乙物质,生成不溶物的量(Y)与加人物的量(X)之间的关系符合图所示的是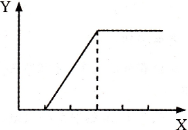
| 甲溶液 |
乙物质 |
|
| A |
NaOH和Ca(OH)2 |
CO2气体 |
| B |
H2SO4和MgSO4 |
NaOH溶液 |
| C |
HCl和CaCl2 |
Na2CO3溶液 |
| D |
Fe2(SO4)3和CuSO4 |
Fe粉 |
如图所示,从a处通入氯气。若打开活塞b,d处的有色布条不褪色;若关闭活塞b,d处的有色布条褪色。下列判断正确的是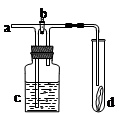
| A.a处通入的是潮湿的氯气 | B.c中盛放的可能是浓硫酸 |
| C.c中盛放的可能是氢氧化钠溶液 | D.c中盛放的可能是饱和食盐水 |
等体积、等物质的量浓度的稀盐酸和氢氧化钠溶液与足量的铝粉反应,产生氢气的质量比是
| A.1:1 | B.1:2 | C.1:3 | D.3:1 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,11.2 L H2O屮所含的分子数为0.5 NA |
| B.常瘟下,32 g O3中所含的原子数为2 NA |
| C.1 mol·L-1NaOH溶液中所含Na+离子数为NA |
| D.5.6 g Fe与2.24 L Cl2充分反应,转移的电子数为0.2 NA |
下列叙述正确的是
| A.工业上用氯气通人纯碱溶液来生产漂白粉 |
B.工业制硫酸的生产过程中,硫元素的转化步骤是:FeS2 SO3 SO3 H2SO4 H2SO4 |
| C.高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 |
| D.在海水中加人石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法 |