设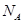 为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是
| A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B.7.8gNa2S和Na2O2中含有的阴离子数大于0.1NA |
C.50mL18.4mol/L浓硫酸与足量铜加热反应,生成 分子的数目为0.46NA 分子的数目为0.46NA |
| D.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
NA为阿伏加德罗常数,下列叙述错误的是()
| A.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| B.常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于 0.1NA |
| C.12 g金刚石中含有的共价键数为2NA |
| D.2.1 g DTO中所含中子数为NA |
下列说法正确的是:
①Cl-的结构示意图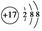 ;
;
②羟基的电子式: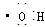 ;
;
③HClO的结构式:H—Cl—O;
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化()
| A.①②⑤ | B.①④⑥⑦ | C.②③④⑥ | D.②③⑤⑥⑦ |
下列图示与对应的叙述相符的是



图1图2图3图4
| A.向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,图1虚线表示加入CuSO4溶液时氢气体积与时间的关系 |
| B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- |
| C.向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图3中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 |
| D.由图4可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验 编号 |
c(HA)起始浓度/(mol·L-1) |
c(KOH)起始浓度/(mol·L-1) |
反应后溶液的pH |
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的 c(H+)=1×10-13 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
下列装置和操作能达到实验目的的是
| A.实验I:制取并收集氢气 |
| B.实验II:验证葡萄糖的还原性 |
| C.实验III:实验室制氨气并收集干燥的氨气 |
| D.实验Ⅳ:检查碱式滴定管是否漏液 |