反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1:5 |
下列叙述正确的是
| A.将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 |
| B.将一小块钠放入盛有水的烧杯中钠在水面上游动,同时看到烧杯内的溶液变为红色 |
C.如图,一段时间后给烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,可看到电极附近有蓝色沉淀生成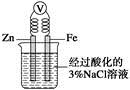 |
| D.向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 |
下列实验操作正确的是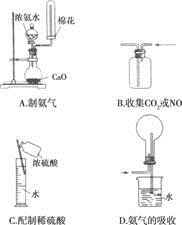
关于下列各实验装置的叙述中,正确的是
| A.装置①制备乙酸乙酯 |
| B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| C.装置③可用于干燥,收集Cl2,并吸收多余的Cl2 |
| D.装置④配制一定物质的量浓度的溶液时转移液体 |
下列叙述正确的是
| A.一定温度、压强下,气体体积由其分子的大小决定 |
| B.一定温度、压强下,气体体积由其物质的量的多少决定 |
| C.气体摩尔体积是指1mol任何气体所占的体积为22.4L |
| D.不同的气体,若体积不等,则它们所含的分子数一定不等 |
下列两种气体的分子数一定相等的是
| A.质量相等、密度不同的N2和C2H4 |
| B.体积相等的CO和N2 |
| C.等温、等体积的O2和N2 |
| D.等压、等体积的N2和CH4 |