某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。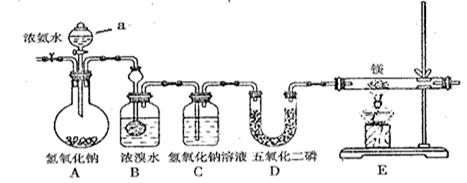
请完成横线上的相关问题:
(1)实验步骤及现象:
① 连接仪器并 。然后,向各仪器中加入适量所需药品。② 。
③ 打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④ 点燃酒精灯,观察到E中固体变成了黄绿色。(氮化镁是黄绿色固体,遇水剧烈反应生成两种碱)
(2)A装置中仪器a的名称为 。
(3)写出B处反应的化学方程式 。
(4)D装置中P2O5是一种非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
| A.NH3 | B.H2 | C.SO2 | D.CO2 |
(5)E装置中发生反应的化学方程式为 。
(6)此装置中存在着明显缺陷,你的改进措施是 。
(7)某同学要探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式 、 。
(8分)实验室常用的几种气体发生装置如图A、B、C所示: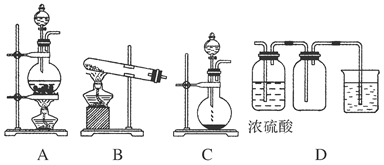
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是________;
检查C装置气密性是否良好的操作方法是________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
(8分)用如下图所示(夹持仪器省略)的装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
①下图中D装置在实验中的作用是__________________________________________;
②若A为浓盐酸,B为KMnO4,C为淀粉KI溶液,旋开E后,C中的现象为____________________,反应的化学方程式是______________________________________;
③若A为浓硫酸(70%),B为Na2SO3,C为酸性KMnO4溶液,旋开E后,C中的现象为________________________________________________________________________,
反应的化学方程式是_______________________________________________;
④若A为30%H2O2溶液,B为MnO2;C为H2S饱和溶液,旋开E后,C中的现象为________________________________________________________________________,
反应的化学方程式是__________________________________________________;
⑤若A为稀盐酸,B为大理石,C为Na2SiO3溶液,旋开E后,C中的现象为________________,反应的化学方程式是__________________________________;
⑥上图所示装置有多种用途,请举例(除题中之外):A为________,B为________,C中盛________,旋开E后,C中的现象为________________,反应的化学方程式是________________________________________________________________________。
(8分)化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
(1)在盛放浓硫酸的试剂瓶的标签上印有如右图所示警示标志,说明浓硫酸是一种________。
(2)下列有关实验操作和安全事故处理错误的有________。
a.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
b.用试管夹从试管底由下往上夹住距管口约处,手持试管夹长柄进行加热
c.把用氯酸钾制氧气后的残渣倒入垃圾桶
d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石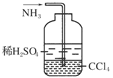
e.配制硫酸溶液时,在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
f.用右图所示装置吸收氨气
(8分)某同学用如图所示装置制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46 g·cm-3。
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
请填写下列空白:
(1)步骤③中观察到的现象是_____________________________________________。
(2)导管a的作用是_______________________________________________________。
(3)C装置中U形管内部用蒸馏水封住管底的作用是
_______________________________________________________________________________________________________________________________________________。
(4)反应完毕后,U形管内的现象是____________________________________________;
分离溴乙烷时所用的最主要仪器的名称是(只填一种)____________________________。
(5)步骤④中能否用大火加热,理由是___________________________________。
(6)为证明溴和苯的上述反应是取代反应而不是加成反应,该同学用装置D代替装置B、C直接与A相连重新操作实验。
①装置D的锥形瓶中,小试管内的液体是________(填名称),其作用是________________;小试管外的液体是________(填名称),其作用是_________________。
②反应后,向锥形瓶中滴加________溶液,现象是__________________,其作用是____________________;装置D还可起到的作用是__________________________________。
相关物质性质如下表所示:
| 物质 |
熔点/℃ |
沸点/℃ |
相对密度(20℃) |
毒性 |
水溶性 |
| 苯 |
5.5 |
80.1 |
0.8794 |
有 |
不溶于水 |
| 硝酸 |
-41.59 |
83 |
1.503 |
易溶于水 |
|
| 硝基苯 |
5.7 |
210.9 |
1.205 |
有 |
不溶于水 |
可供选择的实验用品:
①仪器:烧杯、大试管、铁架台(带铁圈)、石棉网、酒精灯、橡皮塞、玻璃管、温度计、分液漏斗等。
②药品:浓硝酸、稀硝酸、浓硫酸、稀硫酸、苯、5%NaOH溶液、蒸馏水等。
请参考以下实验设计思路,讨论并回答有关问题。
(2)选择合适的实验仪器及条件
①采用的加热方式:
________________________________________________________________________,
其优点是
________________________________________________________________________。
②反应物均为________,采用________作反应器。
③反应过程中由于有易挥发的物质,为防止损失采用________,其兼起________作用。
④用________来控制________的温度。
⑤请画出实验装置简图。
(2)安排合理的实验步骤
①按装置图组装好实验仪器。
②在大试管里,先加入1.5 mL浓硝酸和2 mL浓硫酸,摇匀,冷却到50~60℃。
③再慢慢滴入1 mL苯,不断轻轻摇动,使之混合均匀,塞好单孔塞。
④放在50~60℃的水浴中加热10 min。
(3)产品提纯
探究讨论:①浓硝酸和浓硫酸的混合顺序能否颠倒?为什么?
________________________________________________________________________。
②浓硫酸的作用是
________________________________________________________________________。