空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤①中用硫酸酸化的目的是__ .步骤②发生反应的离子方程式为 。
(2)步骤④利用了SO2的还原性,反应的离子方程式:__________________________.
(3)步骤⑥的名称是 ____________ 。
(4)从含溴水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是: 3Na2CO3+3Br2= NaBrO3+ 5NaBr+ 3CO2;吸收1mol Br2时,转移的电子数为 mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
(5)化学上将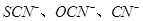 等离子称为“类卤离子”。现将KSCN溶液滴加到酸性
等离子称为“类卤离子”。现将KSCN溶液滴加到酸性 溶液中,溶液立即变成血红色;通入
溶液中,溶液立即变成血红色;通入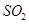 后,血红色消失。血红色消失过程中发生反应的离子方程式为 。
后,血红色消失。血红色消失过程中发生反应的离子方程式为 。
有机物中,有一些分子式符合通式CnHn,如C2H2、C6H6等。
(1)关于这些有机物的说法中正确的是(选填编号)。
| A.可能互为同系物 | B.在空气中燃烧时火焰明亮且产生黑烟 |
| C.一定能使酸性高锰酸钾溶液褪色 | D.等质量的这些有机物完全燃烧时耗氧量相同 |
(2)写出分子式为C4H4且为链烃的有机物的结构简式,它的一氯代物的同分异构体有种。
(3)写出分子式为C6H6且结构中只有C-C键和C-H键的有机物结构简式:。
(4)某有机物分子式为C8H8,且属于芳香烃,已知它可使酸性高锰酸钾溶液和溴水褪色,则该有机物的结构简式为,写出其发生加聚反应的化学方程式。
(12分) (1)已知丙酮[ CH3COCH3 ]键线式可表示为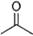 根据键线式回答下列问题:
根据键线式回答下列问题: 分子式:,结构简式:。
分子式:,结构简式:。
(2)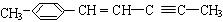 分子中最多有 个原子共直线;最多有个原子共平面。
分子中最多有 个原子共直线;最多有个原子共平面。
(3)写出乙烯分子的电子式:。
(4)有机物(CH3)2CHCH(C2H5)CH=CH2的名称是。
(5)写出甲苯制TNT化学方程式。
(6)  的一氯取代物有种,
的一氯取代物有种, 的二氯取代物有种。
的二氯取代物有种。
(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。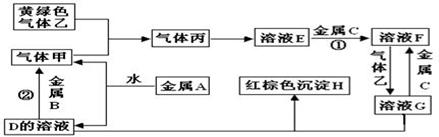
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____________;H ______________; G___________;乙____________。
(2)写出下列反应的化学方程式:
反应①___________________________________________________________;
反应②___________________________________________________________。
(8分)甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是
________ ;写出 乙→丙转化的化学方程式 :___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是___________;写出 甲→乙转化的离子方程式_________________________________________。
(12分)以下表格中的实验是以CuSO4为例,分析电解质在溶液里所起反应的实质