已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。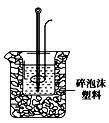
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误装置测定,结果会 (填“偏高”“偏低”“无影响”)
③如果该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理由是: 。在该实验中需要测定某种数据,完成一次实验,需要测定该数据的次数为 次。使用正确的装置进行实验,取上述溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=
I. 维生素C能增强人体对疾病的抵抗能力。
(1)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈性。
(2)维生素C在酸性环境中比较稳定,在高温时易被破坏。请你想一想,如何食用黄瓜,才能充分利用黄瓜种丰富的维生素C? 。
。
II.蛋白质、糖类、无机盐、维生素、油脂、水等被称为 六大营养素。某品牌脱脂奶粉包装袋上标出的配料如下:①脱脂乳②白砂糖③乳酸亚铁④维生素A ⑤维生素D等。请你写出:
六大营养素。某品牌脱脂奶粉包装袋上标出的配料如下:①脱脂乳②白砂糖③乳酸亚铁④维生素A ⑤维生素D等。请你写出:
(1)该产品配料中属于营养素的有 (填编号,下同)。
(填编号,下同)。
(2)人体缺铁,会引起缺铁性贫血,该奶粉中物质可以补充铁元素。
8分)下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品 名 |
×××××× |
| 配 料 |
精炼植物油、鲜鸡蛋、精面粉、碳酸氢钠、日落黄、甜蜜素、山梨酸钾等 |
| 保质期 |
90天 |
| 生产日期 |
标于包装袋封口上 |
(1) 富含蛋白质的是_________ _______ (2)富含糖类的是______________
_______ (2)富含糖类的是______________
(3)富含油脂的是_________________(4)属于防腐剂的是
在一定体积密闭容器中,进行如下反应: CO2(g
CO2(g ) + H2(g)
) + H2(g) CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1) K的表达式为:
(2) 该反应为 反应(“吸热”或“放热”)
(3) 能判断该反应是否达到化学平衡状态的依据
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4)在830℃时,若起始浓度c(CO)为1mol·L—1,c(H2O)为1mol·L—1,反应达到平衡时,CO的转化率为。
铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O。试回答:
(1)铅蓄电池正极的电极材料是__________。
(2)工作时该铅蓄电池负极的电极反应是__ ___________________________________。
(3)铅蓄电池工作时,电解质溶液的密度__________(填“减小”“增大”或“不变”,下同),pH__________。
(4)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05 mol Cl2时,在理论上电池内部消耗的H2SO4的物质的量是____________。
(1)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是。
(2)利用右装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应该置于处。若X为锌,开关K置于M 处,该电化学防护法称为。
处,该电化学防护法称为。