N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g)ΔH>0 ;T1温度下的部分实验数据为:
4NO2(g)+O2(g)ΔH>0 ;T1温度下的部分实验数据为:
| t/s |
0 |
500 |
1 000 |
1 500 |
| c(N2O5)/mol/ L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1 000 s时N2O5转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
某结晶水合物的化学式为R•nH2O,其相对分子质量为M。25℃时,将a g该晶体溶于b g H2O中恰好形成V mL饱和溶液。下列表达式正确的是 ( )
A.饱和溶液物质的量浓度为: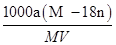 1000 a(M -18n) mol/L 1000 a(M -18n) mol/L |
B.饱和溶液溶质的质量分数为: |
C.25℃时R的溶解度为: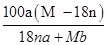 g/100 g H2O g/100 g H2O |
D.饱和溶液的密度为: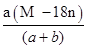 g/mL g/mL |
今有一混合物的水溶液,只可能肯有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是 ( )
| A.K+可能存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
下列反应的离子方程式错误的是 ( )
| A.等物质的量的Ba (OH)2与NH4HSO4在溶液中反应: Ba2++2OH-+NH4++H++SO42-  BaSO4+NH3•H2O+H2O BaSO4+NH3•H2O+H2O |
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+ Fe3++3H2O Fe3++3H2O |
C.足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O 2HCO3- 2HCO3- |
D.酸性条件下KIO3溶液和KI溶液反应生成I2:IO3-+5I-+3H2O  3I2+6OH- 3I2+6OH- |
一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( )
| A.加入少量水,产生H速率减小,H2体积不变 |
| B.加入NH4HSO4固体,产生H2速率不变,H2体积不变 |
| C.加入CH3COONa固体,产生H2速率减小,H2体积减小 |
| D.滴加少量CuSO4溶液,产生H2速率变大,H2体积减小 |
取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水原混合物中氧元素的质量是 ( )
| A.6.4g | B.3.2g | C.1.6g | D.0.8g |