某化学课外小组同学在实验室做酸碱中和滴定实验,他们准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.2000mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
| |
NaOH溶液起始读数 |
NaOH溶液终点读数 |
| 第一次 |
0.02mL |
18.60mL |
| 第二次 |
0.04mL |
18.66mL |
| 第三次 |
0.20mL |
20.60mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.0001)
(2) 下列有关滴定的操作正确的顺序是
①用标准液润洗滴定管 ②往滴定管中注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤加水洗涤
A.⑤①③②④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.2000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? 填 “是”或“否”)
(5)另一小组同学用标准盐酸滴定未知浓度的NaOH溶液,若测定结果偏高,则产生误差的原因可能是
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,未用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.配置NaOH溶液时,NaOH固体中混有少量KOH固体
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题: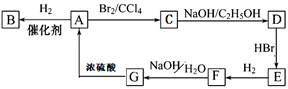
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为______________________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______________________________。
(3)写出由C生成D的化学方程式______________________________反应类型是__________,由G生成A的化学方程式______________________________反应类型是__________。由G生成F的化学方程式______________________________反应类型是__________。G发生催化氧化的化学方程式______________________________。
(4)F的核磁共振氢谱图有__________个吸收峰,峰面积之比为__________。
(2014)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下: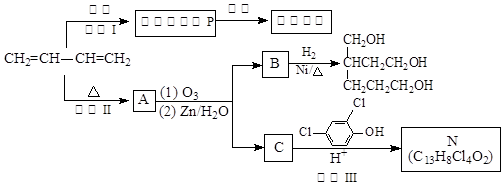

(1)CH2=CH—CH=CH2的名称是________________________。
(2)反应I 的反应类型是(选填字母)_________。
a.加聚反应 b.缩聚反应
(3)顺式聚合物P的结构式是(选填字母)________。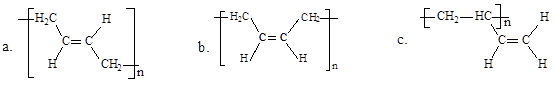
(4)A的相对分子质量为108。
①反应II的化学方程式是_________________________________________。
②1 molB完全转化成M所消耗的H2的质量是_______g。
(5)反应III的化学方程式是___________________________________________。
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式____________________________。
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为______________________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______________________________。
(3)写出由C生成D的化学方程式______________________________反应类型是__________,由G生成A的化学方程式______________________________反应类型是__________。由G生成F的化学方程式______________________________反应类型是__________。G发生催化氧化的化学方程式______________________________。
(4)F的核磁共振氢谱图有__________个吸收峰,峰面积之比为__________。
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是。
(2)pH≈4的原因是(用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是;证明原因②的实验方案是。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。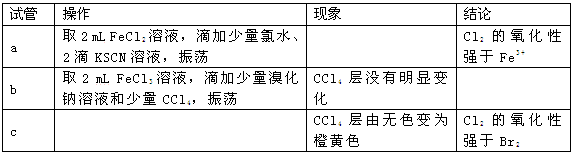
(共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
( )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
( )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
( )用量筒取浓硫酸______mL。
( )将容量瓶盖紧摇匀。
( )将已冷却的硫酸溶液沿________ 注入________ 中。
( )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
( )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、偏低、无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)稀释过程中不慎有硫酸液滴溅出____________;
(3)未将洗涤液加入容量瓶___________;
(4)定容时仰视刻度线__________;
(5)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)配制前容量瓶用水洗涤后未进行干燥处理__________。