白酒、食醋、蔗糖、淀粉等均为家庭厨房中常见物质,利用这些物质能完成的实验是
①白酒中是否含甲醇 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸( )
| A.①② | B.①③ | C.①②③ | D.②③ |
在强碱性的无色溶液中能大量共存的离子组是
| A.K+、Mg2+、MnO4—、C1— | B.Na+、Ba2+、NO3—、C1— |
| C.Na+、H+、SO42—、C1— | D.Ca2+、K+、CO32—、NO3— |
在下列转化中必须加入还原剂才能实现的是
| A.CaCO3 → CO2 | B.CuSO4→Cu |
| C.H2O→H2 | D.C→CO2 |
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤②蒸发③溶解④向容量瓶转移液体
| A.①和② | B.①和③ | C.①和④ | D.③和④ |
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是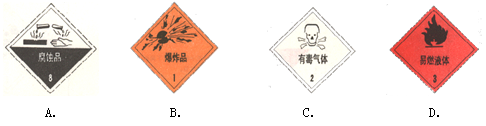
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10-5 |
A.上述生成Ni(CO)4的反应为吸热反应
B.25 ℃时,反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
D.80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时υ(正)>υ(逆)