下列属于氧化还原反应的是( )
| A.NaOH + HCl ="=NaCl" + H2O |
| B.Zn + 2HCl ==ZnCl2 + H2 ↑ |
C.2NaHCO3 Na2CO3+ H2O+CO2↑ Na2CO3+ H2O+CO2↑ |
| D.CuO +2HCl ==CuCl2 + H2O |
下列各原子或离子的电子排布式错误的是
| A.Si 1s22s22p2 | B.O2– 1s22s22p6 |
| C.Na+ 1s22s22p6 | D.Al 1s22s22p63s23p1 |
某离子晶体的晶胞结构如图所示:则该离子晶体的化学式为
| A.abc | B.abc3 | C.ab2c3 | D.ab3c |
下列叙述正确的是
| A.分子晶体中的每个分子内一定含有共价键 |
| B.金属晶体的熔点和沸点都很高 |
| C.离子晶体中可能含有共价键 |
| D.原子晶体中的相邻原子间只存在非极性共价键 |
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是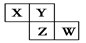
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性W比Z弱 |
| C.Y的气态氢化物的稳定性较Z的弱 |
| D.四种元素的单质中,Z的熔点最高 |
根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速度为L<Q
C.M与T形成的化合物具有两性D.L2+与R2-的核外电子数相等