(1) 3.01×1024个OH-的物质的量为 ___ ,质量为 _______ ,这些OH-与标准状况下 L NH3的物质的量相等,如果这些OH-自2L的Ba(OH)2溶液,则该Ba(OH)2的物质的量浓度为 。
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的质量之比为_________ ____,所含电子数之比为____________,相同质量的氨气和硫化氢气体的分子数之比为__________密度之比为______________,。
在下列反应式中的括号里填上恰当的反应物
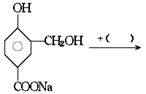
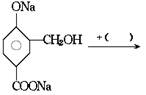

几种短周期元素的原子半径及其某些化合价见下表:
| 元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
| 常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于周期,族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_________________。
(3)A与J所形成的化合物的晶体类型是。
(4)DB2的结构式。
(5)过量的D的最高价氧化物与一定量的J的最高价氧化物对应水化物X的溶液发
生反应的离子方程式:。
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
①浸泡海带:取海带500g,加13~15倍水量分两次浸泡,得浸出液6000mL左右,碘含量为0.5g/L。
②碱化浸出液除褐藻糖胶:即海带浸出液1000mL,加入浓度为40% 的NaOH溶液,控制pH值为12左右,充分搅拌后使褐藻酸钠絮状沉淀而沉降。采用倾析法分离出清液。
③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
④交换吸附:氯型强碱性阴离子交换树脂(R—Cl表示)注入交换柱中(树脂层高度为12cm),如右图连接交换装置,待溶液全部通过后,树脂颜色变为黑红色。
⑤洗脱:分两步进行
第一步:取8~10% 的NaOH溶液40mL注入交换柱中。在强碱作用下,树脂颜色逐渐变浅,待树脂基本褪色后,放出溶液,收集于一小烧杯中为碱性洗脱液。
第二步:取10% 的NaCl溶液40mL注入上述交换柱中。稍待一会儿,慢慢放出溶液收集于另一小烧瓶中,为氯化钠洗脱液。
⑥往碱性洗脱液中滴加H2SO4溶液(6mol/L),烧杯底部会析出一层泥状粗碘。
⑦往氯化钠洗脱液中滴加H2SO4溶液(6mol/L)使之酸化,再滴加10% 的NaNO2溶液(在通风橱中进行)。待溶液由无色转变为棕红色直至出现棕黑色浑浊。
⑧离心分离即得粗碘。
试回答下列问题
(1)步骤③在酸性条件下用NaClO(或H2O2)氧化碘的离子方程式: ,
及I2 +I- I3-。如何用化学方法检验有多碘离子生成。
I3-。如何用化学方法检验有多碘离子生成。
(2)第④步发生的离子反应为:。
(3)步骤⑤洗脱时第一步发生的离子反应为(洗脱液中含有I-和IO3-离子):
;第二步洗脱发生的离子反应为:。
(4)步骤⑦发生反应的离子方程式为 。
为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的极性分子是 。
A.N2 B.O2 C.H2O D.CO2E.CH4
(2)下列说法不正确的是。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的是。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成, 且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为。
A. [ CoCl2(NH3)4 ]Cl·NH3·H2O; B. [ Co(NH3)5(H2O)]Cl3;
C. [ CoCl2(NH3)3(H2O)]Cl·2NH3; D.[ CoCl(NH3)5]Cl2·H2O。
(6)题(5)中钴离子在基态时核外电子排布式为:。
经研究发现有白蚁信息素有: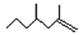 (2,4-二甲基-1-庚烯) ,
(2,4-二甲基-1-庚烯) ,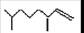 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH—CH=CH(CH2)8CH3。试完成下列问题:
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH—CH=CH(CH2)8CH3。试完成下列问题: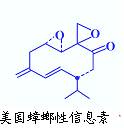
(1)下列说法正确的是。
| A.以上三种信息素互为同系物 | B.以上三种信息素均能使溴的四氯化碳溶液褪色 |
| C.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| D.家蚕信息素与1molBr2加成产物只有一种 |
(2)烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种;烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则B的结构简式为:。C的结构简式为:。
(3)美国蟑螂性信息素结构式如右图,分子中含有手性碳原子 个;有机物E与该信息素互为同分异构体,E能发生银镜反应又能与碳酸氢钠溶液反应,若E表示为: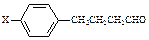 ,X可能的结构有种。
,X可能的结构有种。