将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+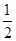 O2(g)==="CO(g)" ΔH=-110.5 kJ·mol-1
O2(g)==="CO(g)" ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是 ( )。
| A.+80.5 kJ·mol-1 | B.+30.0 kJ·mol-1 |
| C.-30.0 kJ·mol-1 | D.-80.5 kJ·mol-1 |
下列说法中正确的是()
| A.电子云通常是用小黑点来表示电子的多少 |
| B.1s22s12p1表示原子的激发态 |
| C.s-s σ键与s-p σ键的电子云形状相同 |
| D.电子仅在激发态跃迁到基态时才会产生原子光谱 |
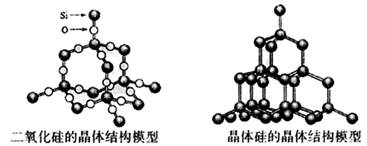
化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,参考下表键能数据和晶体硅与二氧化硅结构模型估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)=SiO2(s)中,ΔH的值为
| 化学键 |
Si—O |
O==O |
Si—Si |
Si—Cl |
Si—C |
| 键能kJ·mol-1 |
460 |
498.8 |
176 |
360 |
347 |
A.- 989.2 kJ·mol-1 B.+ 989.2 kJ·mol-1
C.-61.2 kJ·mol-1D.-245.2 kJ·mol-1
下列离子方程式书写错误的是
| A.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合: NH4++Al3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓ + Al(OH)3↓ + NH3·H2O |
| B.向足量的NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液: 2HCO3-+Ba2++2H++SO42-=2H2O+2CO2↑+BaSO4↓ |
| C.向NaHSO4溶液中逐渐滴入Ba(OH)2溶液至沉淀完全:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全:2OH-+Mg2+=Mg(OH)2↓ |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4 、H2O2、H2SO4 |
K2SO4 、MnSO4...... |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- ...... |
Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰1
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- >Cl2 >Br2>Fe3+
有机物A的相对分子质量为128,燃烧只生成CO2和H2O,若A含一个六元碳环且可与NaHCO3溶液反应,则该有机物环上一氯代物的数目为
| A.5 | B.4 | C.3 | D.2 |